Diretrizes do Consórcio de Implementação de Farmacogenética Clínica (CPIC) para Terapia de Rasburicase no Contexto do Genótipo de Deficiência de G6PD
Abstrato
A deficiência de glicose-6-fosfato desidrogenase (G6PD) está associada ao desenvolvimento de anemia hemolítica aguda (AHA) induzida por vários medicamentos. Fornecemos orientações sobre quais genótipos de G6PD estão associados à deficiência de G6PD em homens e mulheres. A rasburicase é contraindicada em pacientes com deficiência de G6PD devido ao risco de AHA e possivelmente metemoglobinemia. A menos que a genotipagem preventiva tenha estabelecido um diagnóstico positivo de deficiência de G6PD, o ensaio enzimático quantitativo continua sendo o esteio da triagem antes do uso de rasburicase. O objetivo deste artigo é ajudar a interpretar os resultados dos testes clínicos de genótipo G6PD para que possam orientar o uso de rasburicase. Diretrizes detalhadas sobre outros aspectos do uso de rasburicase, incluindo análises de custo-efetividade, estão além do escopo deste documento. As diretrizes do Clinical Pharmacogenetics Implementation Consortium (CPIC) são publicadas e atualizadas periodicamente em https://www.pharmgkb.org/page/cpic para refletir os novos desenvolvimentos no campo.
Farmacologia Clínica e Terapêutica (2014); 96 2, 169–174. doi:10.1038/clpt.2014.97
REVISÃO DE LITERATURA FOCADA
Foi realizada uma revisão sistemática da literatura focada em G6PD, deficiência de glicose-6-fosfato desidrogenase (G6PD) e uso de rasburicase (ver Material Suplementar online (Revisão Focada da Literatura)); revisões 1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 foram usadas para resumir informações básicas. Esta é a primeira diretriz do Clinical Pharmacogenetics Implementation Consortium (CPIC) a focar na G6PD e a primeira a focar em um farmacogene no cromossomo X. Embora a deficiência de G6PD aumente a suscetibilidade ao estresse oxidativo induzido por muitos outros agentes além da rasburicase, para muitos deles, as modificações de prescrição recomendadas não são claras, enquanto para a prescrição de rasburicase deve ser claramente modificada com base no status de G6PD, já que os rótulos de medicamentos de muitos países contraindicam o uso de rasburicase naqueles com deficiência de G6PD. As futuras diretrizes do CPIC abordarão outras drogas afetadas pela G6PD.
GENE: G6PD
G6PD é a enzima que converte glicose-6-fosfato em 6-fosfogluconolactona, a primeira etapa da via das pentoses fosfato (PharmGKB; https://www.pharmgkb.org/pathway/PA165971634). 5 Ao mesmo tempo, a G6PD produz fosfato de dinucleotídeo de nicotinamida adenina (NADPH) reduzido a partir do fosfato de dinucleotídeo de nicotinamida adenina. A G6PD é expressa de forma ubíqua e é particularmente importante nos eritrócitos porque nessas células a G6PD, juntamente com a 6-fosfogluconato desidrogenase (outra enzima na via das pentoses fosfato), é a única fonte disponível de NADPH. 2 , 3 , 9 O NADPH é necessário para proteger os eritrócitos do estresse oxidativo. 8 , 9 , 10 O estresse oxidativo pode ser imposto por várias substâncias, incluindo radicais de oxigênio e peróxido de hidrogênio, que podem ser gerados fisiologicamente ou podem resultar da exposição a agentes exógenos, como drogas terapêuticas. 8 , 9 , 11 Eritrócitos deficientes em G6PD têm uma capacidade muito reduzida de produção de NADPH; portanto, eles são deficientes em lidar com o estresse oxidativo e, portanto, são mais suscetíveis à lise induzida por drogas (incluindo a rasburicase), que pode se manifestar clinicamente como anemia hemolítica. 2 , 3 , 8 , 9 Além disso, a oxidação do ferro da hemoglobina resulta na formação de metemoglobina, uma forma de hemoglobina que não pode transportar oxigênio ou dióxido de carbono. A metemoglobinemia é definida como uma condição na qual o nível de metemoglobina é >1% no sangue circulante e se manifesta clinicamente com uma descoloração da pele que simula cianose e, em casos graves, pode levar a arritmias, convulsões e morte. 10, 11, 12
Atualmente, existem mais de 180 variantes genéticas relatadas de G6PD (Tabela Suplementar S1 on-line; consulte Material Suplementar on-line (Nomenclatura de Variantes Genéticas G6PD e Classe da OMS)). 13 , 14 , 15 A maioria das variantes genéticas na G6PD são variantes sem sentido, resultando em substituições de um único aminoácido; alguns são deleções de um ou mais aminoácidos. 14 A falta de grandes deleções e de variantes frameshift parece consistente com a constatação de que uma completa ausência de atividade da enzima G6PD é fatal in utero, como foi demonstrado em camundongos knockout para G6PD. 16 A maioria das variantes genéticas que resultam em baixa atividade da enzima G6PD afeta a estabilidade da enzima, com as variantes mais severas (geralmente deleções in-frame) causando alterações predominantemente na interface do dímero da proteína G6PD no exon 10 ou próximo a ela, o que afeta a formação do dímero e ligação do substrato. 9 , 14
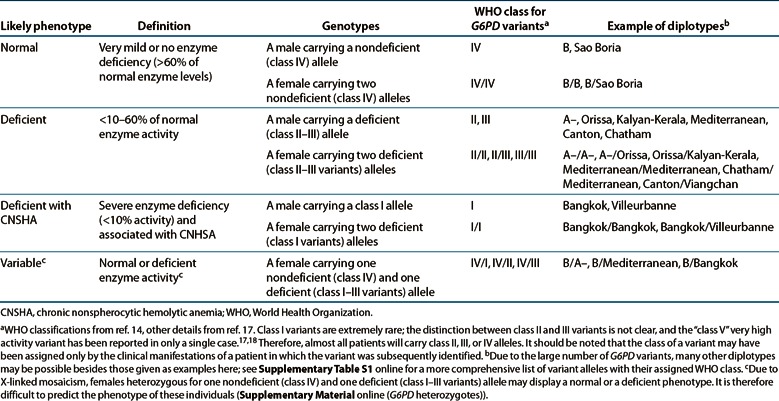
Historicamente, as variantes genéticas da G6PD foram divididas em cinco classes, 3 sendo a classe I a mais gravemente disfuncional e a classe V com a maior atividade enzimática. A classificação foi baseada em dois critérios: (i) o nível de atividade da G6PD nas hemácias e (ii) apresentação clínica de indivíduos portadores dessas variantes (Tabela Suplementar S2 online). Dado que o G6PD está no cromossomo X, as classificações foram baseadas principalmente em avaliações em homens; com apenas uma cópia do gene, sua atividade enzimática de eritrócitos reflete o único alelo que eles carregam (ver Material Suplementar online (G6PD Genetic Variant Nomenclature and WHO Class and G6PD heterozigotos) e Supplementary Tables S1 and S2 online). 3 , 15 , 17 As variantes da G6PD são definidas como classe I quando associadas à anemia hemolítica não esferocítica crônica (CNSHA): são encontradas em pacientes que apresentam hemólise mesmo na ausência de qualquer desafio e geralmente apresentam uma atividade da G6PD inferior a 10% do normal nos glóbulos vermelhos. 3 , 15 , 18 Assim, os pacientes com variantes de classe I têm uma síndrome clínica reconhecível ao longo da vida; além disso, as variantes de classe I são muito raras (muitas delas foram relatadas apenas uma vez). As variantes de Classe II são aquelas com atividade de G6PD inferior a 10%, mas sem CNSHA. As variantes da classe III são aquelas com atividade da G6PD entre 10 e 60% do normal. As variantes nas classes II e III são assintomáticas na maioria das vezes (por definição não há CNSHA), mas são clinicamente importantes porque acarretam o risco de anemia hemolítica aguda (AHA) induzida por drogas. Dos milhões de pessoas com deficiência de G6PD, quase todas carregam pelo menos uma variante de classe II ou III. Como, por definição, as variantes de classe II têm uma atividade média da enzima G6PD menor do que as variantes de classe III, é lógico que a AHA pode ser mais grave com a primeira do que com a segunda. No entanto, isso não significa que as variantes da classe III possam ser consideradas “suaves”; por exemplo, em ensaios de dapsona em crianças com G6PD A– (classe III), 98% dos homens com deficiência de G6PD desenvolveram AHA, 11% dos quais precisaram de transfusão de sangue. 19 Assim, uma divisão nítida entre as variantes das classes II e III pode não ser mais clinicamente útil. 18 A classe IV compreende variantes com atividade normal: a grande maioria tem G6PD B, mas cerca de 20% daqueles de ascendência africana têm G6PD A. 18 A classe V é reservada para variantes com atividade acima do normal; no entanto, nenhum foi relatado desde o relatório de G6PD Hektoen. 18
Para o propósito desta diretriz, as categorias de fenótipos de G6PD consideradas (Tabela 1) são G6PD deficiente com CNSHA, G6PD deficiente, G6PD normal e G6PD variável. 18 Assim, quase todos os indivíduos classificados como “deficientes em G6PD” são aqueles com variantes da classe II ou classe III da OMS; eles geralmente são assintomáticos (sem CNSHA), mas ainda correm o risco de AHA, favismo e icterícia neonatal. 18 Indivíduos classificados na categoria “variável” consistem em mulheres que carregam um alelo não deficiente (classe IV) e um deficiente (variantes de classe I–III); devido ao mosaicismo ligado ao X, é impossível prever sua atividade com base apenas no genótipo.
tabela 1
Atribuição de fenótipos G6PD prováveis com base no genótipo/diplótipo
Estima-se que quase 5% da população mundial tenha deficiência de G6PD, com quase todos portadores de variantes de classe II ou III. 20 A frequência média de deficiência de G6PD em países endêmicos de malária, como os da Ásia e da África, é maior, mas variável, com uma prevalência em certos grupos populacionais de até 30% ou mais 3 , 20 , 21 (Tabelas complementares S3–S5 online ).
Interpretação do teste genético
O gene G6PD está no cromossomo X (Xq28; ref. 2). Os resultados do genótipo associados à deficiência de G6PD podem ser relatados como (i) homem hemizigótico (por exemplo, um alelo variante de classe I–III), (ii) mulher homozigótica (dois alelos idênticos de classe I–III deficientes com a mesma variante), (iii) fêmea heterozigota composta (dois alelos deficientes de classe I–III diferentes com diferentes variantes) e (iv) fêmea heterozigótica (um alelo classe IV normal e um alelo classe I–III deficiente) (Tabela 1). As variantes conhecidas de inativação ou de baixa função (variantes de classe I, II e III) são fornecidas na Tabela Suplementar S1 online. Se essas variantes estiverem presentes, elas podem ser interpretadas conforme definido na Tabela 1 e, em alguns casos, um diagnóstico de deficiência de G6PD pode ser feito com base nos resultados genotípicos. Homens hemizigóticos, mulheres homozigóticas e mulheres heterozigóticas compostas são classificados como deficientes em G6PD ou deficientes em G6PD com CNSHA (Tabela 1). Para os raros pacientes do sexo masculino que têm um cromossomo X extra (ou seja, síndrome de Klinefelter), o genótipo G6PD deve ser interpretado como se fosse do sexo feminino. 22, 23
A determinação do fenótipo G6PD em mulheres heterozigotas (um alelo classe IV normal e um alelo classe I-III deficiente) não é possível com base apenas em testes genéticos devido à inativação do cromossomo X em mulheres. Essa inativação do cromossomo X, que pode ocorrer em uma porcentagem variável de células somáticas, inativa o alelo normal ou o de baixa atividade e se traduz em mulheres heterozigotas com um mosaico de eritrócitos normais com G6PD e deficientes em G6PD. A atividade enzimática geral resultante será variável porque a proporção dos dois tipos de hemácias é altamente variável e pode mudar ao longo do tempo no mesmo indivíduo. 2 , 3 , 24 Assim, a atividade de G6PD em mulheres heterozigotas pode ir de normal a deficiente de G6PD e, portanto, os heterozigotos podem exibir um perfil de AHA induzido por drogas semelhante ao dos homozigotos 2 , 19 (Material Suplementar online ( G6PD Heterozigotos)). Assim, um teste de atividade enzimática é necessário para atribuir o fenótipo G6PD em mulheres heterozigotas.
Como a maioria dos testes genéticos não interroga exaustivamente todas as variantes associadas à deficiência de G6PD e porque o fenótipo de mulheres heterozigotas genotipicamente comprovadas é imprevisível, a maioria dos diagnósticos de deficiência de G6PD é atualmente feita por meio de testes de atividade enzimática em vez de genótipo. 20 No sexo masculino, os resultados da atividade da enzima G6PD geralmente são claros, inclusive em recém-nascidos, que tendem a ter atividade maior do que a observada em crianças maiores e adultos. 25 , 26 , 27 O principal risco de erro de classificação em homens é quando houve hemólise recente (porque G6PD em reticulócitos e em eritrócitos jovens é maior) ou transfusão de sangue recente (porque o sangue transfundido provavelmente é G6PD normal); um ou ambos podem deslocar um nível de enzima deficiente em G6PD próximo ou mesmo dentro da faixa normal. Nas mulheres, pode haver sobreposição na atividade entre homozigotos normais e heterozigotos de G6PD e entre heterozigotos e homozigotos deficientes; pode haver também mais variabilidade intrasujeito na atividade de G6PD do que em homens (Material Suplementar online (G6PD Heterozigotos)). Programas universais de triagem neonatal para deficiência de G6PD por meio do uso de teste de ponto fluorescente semiquantitativo ou ensaio quantitativo de atividade enzimática foram instituídos ou propostos em áreas com alta incidência de deficiência de G6PD, como Ásia, Europa, África e Oriente Médio (Tabelas Suplementares S3 e S4 online para frequências nos principais grupos raciais/étnicos).
Opções de teste genético disponíveis
As opções de testes genéticos disponíveis comercialmente mudam com o tempo (Material Suplementar online (Opções de Testes Genéticos Disponíveis) e https://www.pharmgkb.org/views/viewGeneticTests.action). Os métodos de triagem genética variam em sua especificidade e sensibilidade. 20 O Programa Nacional de Triagem Neonatal dos Estados Unidos testa rotineiramente a deficiência de G6PD por meio de genotipagem no estado da Pensilvânia e no Distrito de Columbia, com um painel de cinco variantes seguido de testes confirmatórios de atividade enzimática. 28 Uma séria limitação aos testes apenas de genótipo é que apenas algumas das variantes conhecidas de G6PD são geralmente incluídas. Essa limitação pode ser superada no futuro pelo sequenciamento completo do gene. No momento, a detecção de variantes de classe I–III em um homem ou de dois alelos de classe I–III em uma mulher é informativa para prever a deficiência de G6PD; por outro lado, um resultado de genótipo “negativo” não descartaria definitivamente a deficiência de G6PD e, portanto, um teste de atividade enzimática seria necessário para avaliar o status de G6PD.
Descobertas incidentais
Anemia hemolítica. Em indivíduos com deficiência de G6PD, o AHA pode ser desencadeado por vários medicamentos diferentes (Tabela Suplementar S6 online); futuras diretrizes CPIC serão desenvolvidas para outras drogas afetadas pela G6PD. A AHA também pode ser desencadeada pela exposição a certos produtos químicos, a favas ou a infecções – todos fatores que causam aumento do estresse oxidativo nos eritrócitos. Às vezes, por exemplo, quando um medicamento é administrado devido a uma infecção, pode ser difícil saber se a causa da AHA é a primeira ou a segunda. 1 , 2 AHA após a ingestão de favas (favas) em indivíduos com deficiência de G6PD é denominado “favismo” e pode ser fatal, principalmente em crianças. 2 , 3 Indivíduos com uma variante de G6PD de classe I têm uma doença ao longo da vida (CNSHA) e, além disso, correm um risco aumentado de episódios hemolíticos extravasculares de agentes desencadeantes exógenos. 2
Icterícia neonatal. Juntamente com outros fatores, a deficiência de G6PD está associada a um risco aumentado de hiperbilirrubinemia neonatal, que se não tratada pode resultar em kernicterus, paralisia cerebral e morte. 3 , 18 , 29 O risco pode aumentar ainda mais naqueles com o alelo UGT1A1*28 (rs8175347) associado à síndrome de Gilbert. 30
Outras manifestações clínicas da deficiência de G6PD. Numerosos estudos investigaram associações entre a atividade da G6PD e uma variedade de doenças; uma análise crítica das evidências dessas associações está além do escopo desta diretriz.
Outras considerações
A extensão da deficiência da enzima G6PD e dos sintomas clínicos varia entre e dentro dos indivíduos e depende do tipo de variante genética da G6PD, do sexo do indivíduo, do agente desencadeante, da presença de infecção concomitante e de outros fatores hereditários que podem afetar a fisiologia eritrocitária (Material Suplementar online (Outras Considerações)). 2 , 3 , 9 , 31
MEDICAMENTO: RASBURICASE
Rasburicase (Elitek, Fasturtec e Rasuritek) é uma enzima urato oxidase recombinante; decompõe o ácido úrico em alantoína hidrofílica e peróxido de hidrogênio. 6 , 7 , 32 , 33 , 34 A rasburicase é aprovada pela Food and Drug Administration (FDA) dos EUA para profilaxia e tratamento da hiperuricemia durante a quimioterapia em adultos e crianças com linfoma, leucemia e tumores sólidos. 32 Uma forma peguilada de urato oxidase, pegloticase (Krystexxa), também é aprovada pela FDA para o tratamento de gota refratária. 35 A rasburicase também tem sido usada em recém-nascidos com ácido úrico elevado associado a lesão renal. Tanto a rasburicase quanto a pegloticase carregam um aviso da FDA e são contraindicadas para uso em pacientes com deficiência conhecida de G6PD. 32 A European Medicines Agency e a Japan’s Pharmaceuticals and Medical Devices Agency também contraindicam o uso de rasburicase em pacientes com deficiência de G6PD (http://www.pharmgkb.org/drug/PA10176) (http://www.pmda.go.jp /english/service/drugs.html).
Ligando a variabilidade genética de G6PD a reações adversas induzidas por rasburicase
A variação na atividade da enzima G6PD foi relacionada a vários genótipos diferentes de G6PD (Tabela Suplementar S1 online). O peróxido de hidrogênio é produzido durante a oxidação do ácido úrico em alantoína pela rasburicase, 6 e isso pode causar anemia hemolítica (e possivelmente metemoglobinemia) após a administração de rasburicase em pacientes com deficiência de G6PD; isso é apoiado por vários relatórios clínicos (consulte a Tabela Suplementar S7 online). Embora muitos dos dados clínicos venham de pequenas séries de casos e relatos de casos, considerados em conjunto e tendo em vista o mecanismo subjacente plausível, muitos países têm advertências nas bulas de medicamentos de que o uso de rasburicase é contraindicado em pessoas com deficiência de G6PD (revisado nas refs. 1, 2 , 3, 4, 5 e 9 , (Tabela 2)).
Tabela 2
Uso terapêutico recomendado de rasburicase em relação ao fenótipo G6PD

Recomendações terapêuticas
Conforme declarado acima, o uso de rasburicase é contraindicado pelo FDA, Agência Europeia de Medicamentos e Agência de Dispositivos Médicos e Farmacêuticos naqueles com deficiência de G6PD 32 , 33 , 34 (ver Tabela 2; Figura 1). Se, com base na genotipagem, um estado de deficiência puder ser inequivocamente atribuído a um paciente, isso seria uma contra-indicação suficiente para o uso de rasburicase. No entanto, devido às limitações do teste genético (discutidas acima), na maioria dos casos é necessário realizar o teste da enzima G6PD para atribuir o status G6PD.
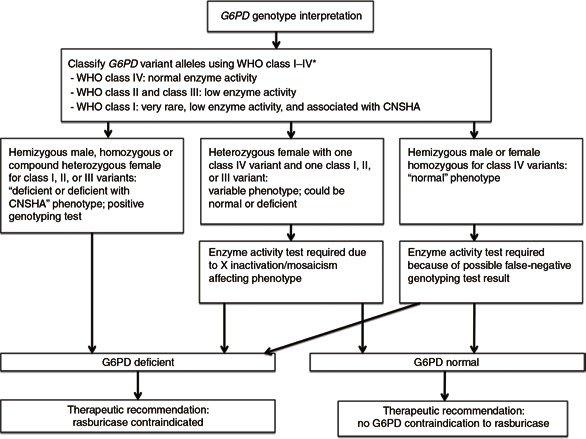
figura 1
Fluxo de trabalho para interpretação do genótipo G6PD e para avaliação da necessidade de um teste de atividade enzimática. *Deve-se notar que a classe de uma variante pode ter sido atribuída apenas pelas manifestações clínicas de um paciente no qual a variante foi posteriormente identificada. 14 CNSHA, anemia hemolítica não esperocítica crônica; OMS, Organização Mundial da Saúde.
A FDA recomenda que pacientes com maior risco de deficiência de G6PD, como aqueles com ascendência africana ou mediterrânea, sejam testados para deficiência de G6PD antes do início da rasburicase. 32 No entanto, deve-se notar que pacientes de todas as origens podem ser deficientes em G6PD. Os rótulos dos medicamentos não mencionam especificamente o teste genético, mas com o aumento da disponibilidade de resultados de testes genéticos, alguns pacientes podem ser diagnosticados preventivamente com deficiência de G6PD; se assim for, tais resultados definitivos podem ser usados para impedir a prescrição de rasburicase e potencialmente outras drogas oxidativas, mesmo na ausência de resultados de atividade da enzima G6PD.
Pediatria. Grande parte da evidência relacionando a deficiência de G6PD à hemólise induzida por rasburicase e metemoglobinemia foi gerada em neonatos ou crianças (Tabela Suplementar S7 online) e, portanto, essas diretrizes se aplicam a neonatos, crianças e adultos.
Recomendações para achados incidentais
Pacientes com deficiência de G6PD devem ser informados de que correm um risco aumentado de hemólise após exposição a favas ou a drogas ou produtos químicos de alto risco (Tabela Suplementar S6 online) e que é recomendado evitar tais compostos (Material Suplementar online ( Drogas Inseguras para Pacientes com Deficiência de G6PD) e Tabela Suplementar S6 online).
Outras considerações
Recomendações para o teste de outros marcadores genéticos estão além do escopo desta diretriz. Agentes conhecidos por induzir ou inibir a expressão de G6PD também podem influenciar o risco de hemólise induzida por rasburicase. 36 Variações na farmacocinética da rasburicase e na dosagem prescrita também podem afetar o risco. 2
BENEFÍCIOS E RISCOS POTENCIAIS PARA O PACIENTE
Dada a contra-indicação para o uso de rasburicase em pacientes com deficiência de G6PD, para uma tomada de decisão ideal, as unidades clínicas que tratam a síndrome de lise tumoral devem ter acesso ao status de G6PD preventivamente ou acesso aos resultados da atividade enzimática com tempos de resposta rápidos. A administração de rasburicase a pacientes com deficiência de G6PD resultou em casos de anemia hemolítica subsequente e metemoglobinemia, que podem ser fatais (Tabela Suplementar S7 online). Claro, a síndrome de lise tumoral pode ser fatal, e a terapia alternativa para redução do ácido úrico, como o alopurinol, pode não ser tão eficaz quanto a rasburicase na redução dos níveis de ácido úrico e tem outros efeitos colaterais potenciais. 37 , 38 O risco de AHA grave e possível metemoglobinemia potencialmente causada pela rasburicase versus o risco de complicações da síndrome de lise tumoral se a rasburicase não for usada deve ser ponderado entre si.
ADVERTÊNCIAS: USO ADEQUADO E/OU POTENCIAL MAU USO DE TESTES GENÉTICOS
Vários testes genéticos disponíveis comercialmente rastreiam apenas algumas das variantes genéticas G6PD mais comuns. Portanto, qualquer paciente pode ter uma variante genética rara, diferente ou previamente desconhecida; assim, um teste genético pode ter sido relatado como “negativo”, mas o paciente pode, ainda assim, ter deficiência de G6PD.
CONCLUSÃO
A rasburicase é contraindicada para aqueles com deficiência de G6PD; infelizmente, o estado de G6PD de um paciente é muitas vezes desconhecido no momento em que a terapia com rasburicase é contemplada. Se um resultado de teste genético estiver disponível preventivamente, será útil apenas se estabelecer deficiência de G6PD; caso contrário, e na maioria dos casos, ainda será necessário um teste enzimático. No futuro, como um número crescente de pacientes terá em seu prontuário uma sequência G6PD completa, a porcentagem de resultados de testes genéticos informativos aumentará e o processo de tomada de decisão sobre se é seguro usar rasburicase será acelerado e facilitado .
Artigo original AQUI

