A deficiência de glicose-6-fosfato desidrogenase (G6PD) é um defeito enzimático hereditário comum e ligado ao cromossomo X, e afeta mais de 400 milhões de pessoas em todo o mundo 1) . Embora os pacientes com deficiência de G6PD muitas vezes permaneçam assintomáticos ao longo da vida, alguns pacientes apresentam manifestações clínicas graves associadas ao estresse oxidativo, como anemia hemolítica e danos neurológicos induzidos por bilirrubina, principalmente em recém-nascidos. A anemia hemolítica associada à G6PD geralmente é desencadeada por agentes exógenos como fava 2) e primaquinas (um antimalárico) e o modo rápido e grave de início dessa manifestação está associado aos efeitos tóxicos ou alérgicos das exposições e grau de deficiência de G6PD nas patentes.
Nesta edição do Journal of Atherosclerosis and Thrombosis, outro fator precipitante para patogenias de deficiência de G6PD é proposto, ou seja, envelhecimento e doença cardiovascular. Dore et ai. conduziram um estudo transversal retrospectivo investigando a associação entre a deficiência de G6PD e a prevalência de doença cardiovascular em 9.604 pacientes com idades entre 18 e 95 anos, submetidos à gastroendoscopia para triagem de H. Pylori 3) . A prevalência geral de deficiência de G6PD em seus participantes foi surpreendentemente alta (11,3%) porque o estudo foi realizado na Sardenha, Itália, que é uma área comum de deficiência de G6PD em lesões mediterrâneas. Nos modelos multivariados, o odds ratio ajustado (OR) da deficiência de G6PD para doença cardiovascular (DCV) foi de 3,24, que é o segundo maior OR após a idade (OR=3,80). Mais importante, a análise estratificada por idade revelou que a deficiência de G6PD está significativamente associada ao aumento do OR de DCV apenas entre aqueles com 60 anos ou mais. Eles confirmaram o aumento relacionado à idade em OR para participantes do sexo masculino e feminino.
Até o momento, os resultados de estudos observacionais sobre a associação entre deficiência de G6PD e DCV são controversos 4 , 5) , possivelmente devido aos seus efeitos pró e antioxidantes nos organismos e às diferenças nas características da coorte. Em um estudo do centro militar dos EUA com 17.338 indivíduos com idade média de 37 anos, a deficiência de G6PD está associada a um aumento de 39,6% no OR de desenvolvimento de DCV 5) . Embora as diferenças nas potenciais mutações causadoras e no grau de deficiência enzimática precisem ser levadas em consideração, o achado de Dore et al. vale a pena discutir que a deficiência de G6PD está associada a OR altamente elevado para DCV em indivíduos afetados com 60 anos ou mais. Existem alguns mecanismos biológicos subjacentes à associação aumentada entre deficiência de G6PD e DCV em idosos. Primeiro, G6PD catalisa a etapa limitante da taxa na via das pentoses fosfato, fornecendo a forma reduzida de nicotinamida adenina dinucreotídeo fosfato, que contribui para a reciclagem na forma reduzida de glutationa, um forte antioxidante no corpo. Portanto, defeitos na G6PD podem acumular estresse oxidativo e subsequente patogênese da aterosclerose. Em segundo lugar, a deficiência de G6PD nas células endoteliais contribui para a diminuição da produção de óxido nítrico (NO) juntamente com a depleção de glutationa 6) . A síntese de NO endotelial é crítica para manter o relaxamento vascular; portanto, a depleção de NO leva à hipertensão, aterosclerose e DCV. Além disso, modelos experimentais mostram que a deficiência de G6PD está associada ao aumento da expressão de moléculas de adesão celular, como ICAM-1 e VCAM-1 7) . Curiosamente, esses mecanismos moleculares e celulares associados à deficiência de G6PD se sobrepõem aos efeitos do envelhecimento na vasculatura, portanto, os idosos com essas mutações genéticas podem ter acelerado o processo aterogênico, que fundamenta a alta prevalência de DCV (Fig.1).
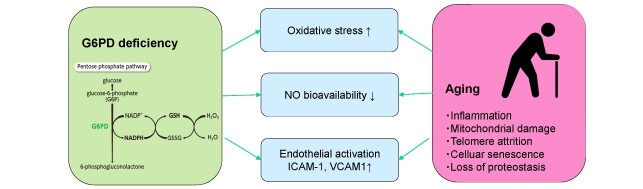
Figura 1.
Efeitos moleculares potenciais da deficiência de G6PD e envelhecimento na doença cardiovascular
O artigo de Dore et al. apresenta um ponto de discórdia interessante, mas muitos desafios estão por vir. Primeiro, suas descobertas devem ser replicadas em um estudo de coorte prospectivo em larga escala da população em geral. Esses estudos devem incluir a medição de biomarcadores de estresse oxidativo e sinalização de NO. Também é interessante comparar áreas com alta e baixa prevalência de deficiência de G6PD. À medida que o envelhecimento da população global e a ameaça de doenças cardiovasculares aumentam, a elucidação da deficiência de G6PD na DCV pode ser importante não apenas para o manejo clínico de pacientes com as mutações, mas também para uma maior compreensão das intrincadas associações entre envelhecimento, estresse oxidativo e aterosclerose.
Leia artigo no site da editora (DOI): 10.5551/jat.ed152
Referências

