Sabemos que recentemente circula a informação de que amoxicilina seria restrito para Deficiência de G6PD, mas será mesmo que essa restrição existe?
Bom, no post de hoje vou trazer um artigo de estudo de caso de suspeita de crise hemolítica pelo uso de amoxicilina, afim de esclarecer o tema.
Um episódio grave de anemia hemolítica após exposição à amoxicilina em um paciente com deficiência de G6PD.
Abstrato
A deficiência de glicose-6-fosfato desidrogenase (G6PD) é a deficiência enzimática mais comum em todo o mundo, com variantes genéticas resultando em uma variedade de fenótipos que variam de assintomáticos a hemólise grave. Relatamos um caso de anemia hemolítica grave em um paciente com deficiência de G6PD cuja única exposição conhecida foi amoxicilina duas semanas antes de seu episódio de hemólise grave, pelo qual ele se apresentou em nosso hospital. Um extenso exame infeccioso e hematológico resultou negativo, com exceção de um resultado positivo de deficiência de G6PD. Embora raro, sugerimos que a anemia hemolítica grave do paciente possivelmente esteja relacionada à exposição à amoxicilina.
1. Fundo
A deficiência de glicose-6-fosfato desidrogenase (G6PD) é a deficiência enzimática mais comum, com cerca de 400 milhões de pessoas afetadas em todo o mundo [1]. Existem diversas variantes da doença, resultando em um amplo espectro de apresentações, variando de assintomática a hemólise grave. Nos tipos mais prevalentes, o Mediterrâneo e a variante A, a hemólise ocorre após exposição a agentes oxidantes, tipicamente antimaláricos ou sulfonamidas; agentes infecciosos, como Parvovírus, Citomegalovírus (CMV) ou Hepatite. Neste relato, apresentamos um caso intrigante de anemia hemolítica grave em um paciente de 23 anos que foi exposto à amoxicilina, dez dias antes da apresentação, e finalmente considerado deficiente em G6PD. Apenas duas associações anteriores de hemólise grave devido à exposição à amoxicilina foram relatadas [2, 3]. Embora rara, nenhuma exposição química infecciosa ou alternativa foi encontrada, e nenhum evento incitador alternativo pôde ser identificado. Nós, portanto, propomos que a apresentação de nosso paciente de anemia hemolítica mediada por G6PD é provavelmente resultado da exposição à amoxicilina.
2. Apresentação do caso
Um homem de 23 anos, bi-racial (hispânico-caucasiano) foi internado em um hospital externo (OSH) com queixas de icterícia, fraqueza generalizada e vômitos. Na admissão, ele apresentava um nível de hemoglobina (Hgb) de 3,7 mg/dl (faixa de referência (RR) 14–18 mg/dl), pancitopenia e hiperbilirrubinemia (bilirrubina total 18,9; RR 0,3–1,2 mg/dl) . O paciente foi internado na Unidade de Terapia Intensiva (UTI) e recebeu 13 unidades de sangue durante sua internação. Um extenso exame, incluindo o Vírus da Imunodeficiência Humana (HIV), Parvovírus B19, Citomegalovírus (CMV), vírus Epstein-Barr (EBV), painel de hepatite e biópsia de medula óssea não foi revelador; no entanto, ele melhorou lentamente e recebeu alta 2 semanas após a admissão com Hgb de 8,0 mg/dl. Dois dias depois, ele desenvolveu dor torácica não irradiada, solicitando atendimento em nosso hospital, momento em que foi constatado Hgb de 8,4 mg/dl. É importante ressaltar que 10 dias antes da admissão na UTI OSH, o paciente havia completado um curso de 14 dias com amoxicilina para uma infecção e subsequente remoção de uma unha encravada. Na apresentação, o paciente negou febre, calafrios, calafrios, dispneia, perda de peso e linfadenopatia. A revisão dos sintomas foi positiva para disúria desde a colocação e posterior remoção de um cateter de Foley na OSH, bem como uma leve dor de cabeça. Ele relatou que estava em seu estado normal de boa saúde até aproximadamente 1 semana após o término do tratamento com amoxicilina, quando começou a se sentir mal. Dois a três dias antes da admissão inicial, ele apresentou êmese não biliosa e não sanguinolenta e náusea com fezes moles. Na manhã da internação, sua urina ficou escura e ele apresentava icterícia, o que motivou seus pais a trazê-lo ao pronto-socorro da SST. Sua história médica pregressa era notável por esquizofrenia paranóide, para a qual ele estava sendo tratado com clonazepam 0,5 mg VO BID, quetiapina 25 mg VO TID PRN, sertralina 200 mg QD e ziprasidona 80 mg BID, todos os quais foram descontinuados na admissão ao OSH. A história cirúrgica pregressa era normal. O paciente não tinha alergias conhecidas e negava uso de drogas ilícitas, tabaco e álcool. Além disso, o paciente era sexualmente inativo. Ele tinha um histórico familiar notável de coágulos sanguíneos inexplicáveis no lado de sua avó agnada. Alguns anos antes da apresentação, ele havia estado no Afeganistão sem nenhuma doença notável. Ao chegar à nossa unidade médica, o exame físico revelou pressão arterial de 125/75 mm Hg, frequência cardíaca de 100 batimentos por minuto (bpm), frequência respiratória de 18 respirações por minuto e temperatura de 98,1 °F. O paciente estava alerta e orientado, mas com aparência ansiosa. O exame cabeça-olho-ouvido-nariz-garganta (HEENT) revelou icterícia escleral, e o exame cardiopulmonar estava dentro dos limites da normalidade, exceto por taquicardia limítrofe. O exame abdominal foi notável por sensibilidade difusa à palpação profunda e esplenomegalia sem hepatomegalia. Nenhum déficit focal foi observado no exame neurológico, os nervos cranianos estavam intactos e nenhum meningismo foi observado.
Os achados laboratoriais demonstraram pancitopenia com baixa contagem de glóbulos brancos (WBC) de 2,3 mil/cmm (RR 4,5–11,0 mil/cmm) e predominância neutrofílica de 68% (RR 37–77%), trombocitopenia com contagem de plaquetas de 105 mil /cmm (RR 150–350 mil/cmm) e hemoglobina e hematócrito de 8,2 mg/dl e 24%, respectivamente (Tabela 1). A contagem absoluta de reticulócitos foi baixa em 0,0134 milhões/cmm (Tabela 1), com um valor relativo que estava no limite inferior do normal em 0,4% (RR 0,4–1,9%). O esfregaço de sangue periférico apresentava-se microcítico com palidez central, conforme Figura 1. Os marcadores linfocitários avaliados por citometria de fluxo não mostraram evidência de expansão linfoide clonal. A eritropoetina estava elevada, o teste de fragilidade osmótica e o ensaio direto de anticorpos de glóbulos vermelhos foram negativos (Tabela 2). Um painel bioquímico completo, incluindo marcadores cardíacos (troponina, creatina quinase, músculo/cérebro (CK-MB), creatina quinase (CK)), foi normal. O exame de urina (AU) revelou proteína 1+, urobilinogênio elevado (4,0 mg/dl; RR 0,1–1,0 mg/dl), esterase leucocitária 2+ e nitritos positivos; a microscopia de urina mostrou 29 RBC/campo de alta potência (hpf) e 185 WBC/hpf. A triagem de drogas na urina foi negativa. Os testes de função hepática revelaram elevação da aspartato aminotransferase (AST)/transaminase glutâmica oxaloacética sérica (SGOT) e alanina aminotransferase (ALT)/transaminase glutamato-piruvato sérica (SGPT), com fosfatase alcalina dentro dos limites da normalidade (Tabela 3). A relação normalizada internacional (INR) foi de 1,21 e a bilirrubina total foi de 4,05 mg/dl (RR 0,31,2 mg/dl) com uma bilirrubina direta de 1,1 mg/dl (RR 0,00–0,34 mg/dl), conforme mostrado nas Tabelas 2 e e3.3. Lactato desidrogenase (LDH) resultou em 1080 U/L (RR 135–225 U/L); o dímero D era 300; a proteína total estava dentro dos limites normais e a proteína C-reativa (PCR) era normal (Tabela 2). Tanto a ferritina quanto o fibrinogênio estavam elevados em 911 ng/ml (RR 10–385 ng/ml) e 426 mg/dl (RR 198–450 mg/dl), respectivamente (Tabelas 2 e e3
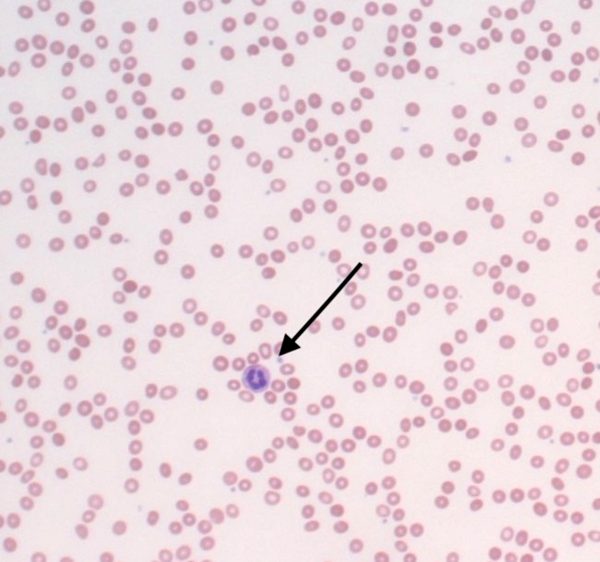
figura 1
Esfregaço periférico microcítico normocrômico com anisopoiquilocitose moderada. Os neutrófilos (seta) estão levemente diminuídos em número, com morfologia normal.
A radiografia de tórax mostrou-se normal e a TC de abdome mostrou esplenomegalia acentuada (não mostrada). As contagens e percentagens de CD 4 eram normais. As aglutininas frias foram negativas, assim como o teste COOMBS. O teste de Donnath Landsteiner também foi negativo (Tabela 2). A investigação infecciosa foi grosseiramente negativa (Tabela 4). A única fonte de infecção encontrada foi a AU do paciente, conforme acima, revelando uma infecção do trato urinário (ITU) que desenvolveu Klebsiella pneumoniae, que foi atribuída a uma sonda Foley de demora durante sua permanência de 7 dias na UTI OSH. Os exames reumatológicos também foram negativos, incluindo Anticorpos anticitoplasma de neutrófilos (ANCA) e fator reumatoide (Tabela 2). Posteriormente, foi realizada biópsia de medula óssea, que evidenciou medula hipercelular (90%) com acentuada hiperplasia eritroide e desvio à esquerda, hiperplasia megacariocítica discreta sem displasia ou atipia, sem infiltrado celular atípico identificado. Uma repetição da contagem de reticulócitos, 11 dias após a admissão, resultou em um valor absoluto de 0,0261 mili/cmm (RR 0,026–0,095 mili/cmm) e um valor relativo de 0,9% (RR 0,4–1,9%). O teste de G6PD por métodos enzimáticos usados para diagnóstico definitivo [4] produziu resultados positivos para deficiência. As necessidades de transfusão do paciente diminuíram, pois ele só precisou de 2 unidades adicionais de concentrado de hemácias e foi tratado para sua ITU com ciprofloxacino. (Observação: Ciplofaxacino é restrito para Deficiência de G6PD)
O paciente recebeu alta com redução gradual de esteroides e ácido fólico. Dois meses após a alta, a hemoglobina normalizou para 15,5 g/dl. Ele continuou a melhorar constantemente em casa e três meses após os sintomas iniciais, ele se recuperou totalmente e voltou ao seu estado anterior de saúde e nível de atividade. Não apresentou mais eventos hemolíticos, porém foi acompanhado em nosso ambulatório de Hematologia/Oncologia.
3. Discussão
A G6PD é a deficiência enzimática mais comum em todo o mundo, com uma prevalência global de 4,9% [1]. Para a maioria das pessoas afetadas, a deficiência de G6PD é assintomática; no entanto, após a exposição a agentes oxidantes ou infecciosos, pode ocorrer hemólise, levando a quedas abruptas nas contagens de sangue, exigindo internação hospitalar e transfusão de sangue. O paciente descrito neste relato de caso apresentou hemólise grave, necessitando de múltiplas administrações de hemoderivados, além de internação prolongada devido à hemólise em curso. Após extensa investigação de testes de laboratório, a deficiência de G6PD foi revelada. Curiosamente, a única nova exposição antes do início da hemólise foi à amoxicilina, que embora rara, já havia sido relatada como indutora de hemólise em dois casos publicados anteriormente [2, 3], sendo um deles em um paciente com deficiência de G6PI [2]. Embora nosso paciente estivesse 10 dias após a exposição na admissão inicial, ele relatou uma história de sintomas de 1 semana, o que se encaixa na linha do tempo relatada nesses casos publicados anteriormente.
A contagem de reticulócitos foi um achado inesperado neste paciente. Em condições de hemólise maciça, uma contagem elevada de reticulócitos seria esperada em uma medula óssea funcionando normalmente. Neste paciente, no entanto, os exames laboratoriais revelaram uma baixa contagem de reticulócitos na admissão. A biópsia da medula óssea revelou uma medula óssea hipercelular, sugerindo uma resposta à hemólise ou envolvimento da medula óssea, que foi descartada com métodos de citometria de fluxo. Uma contagem de reticulócitos repetida 11 dias após a apresentação indicou uma melhora leve, mas a resposta permaneceu abaixo do ideal. Crise aplástica foi relatada anteriormente em pacientes com deficiência de G6PD, no entanto, estes foram encontrados como resultado de infecções virais incitantes, como CMV [5] e Parvovírus [6], que não foram detectados em nosso paciente. Além disso, a esplenomegalia tem sido associada à hemólise contínua em pacientes com deficiência de G6PD e pode explicar a falta de reticulocitose devido ao sequestro esplênico e subsequente destruição.
A duração prolongada da hemólise crônica contínua foi semelhante à observada nas anemias hemolíticas autoimunes. No entanto, o argumento contra essa etiologia foi um teste de Coombs negativo, bem como uma alta bilirrubinemia, que não é tipicamente observada em reações imunomediadas. Depois de esgotar nossa investigação para possíveis desencadeadores de hemólise em pacientes com deficiência de G6PD, nenhuma outra fonte alternativa responde por nossos achados. Além de induzir hemólise em pacientes com deficiência de G6PD, amoxicilina e combinações de amoxicilina/ácido clavulânico têm sido relatadas como causadoras de neutropenia e pancitopenia em pacientes sem deficiência de G6PD sendo tratados para uma variedade de infecções [7-9]. Além disso, existem 97 relatos de falência da medula óssea associada à amoxicilina que foram relatados à Food and Drug Administration (FDA) dos EUA [10]. Além disso, há muitos relatos da associação de antibióticos amoxicilina/ácido clavulânico causando hepatotoxicidade [11] e alguns relatos de amoxicilina isoladamente causando hepatite [12,13], como observado em nosso paciente.
O estresse oxidativo é um mecanismo conhecido de episódios hemolíticos induzidos por drogas em pacientes com deficiência de G6PD [14-16]. A G6PD protege as células do estresse oxidativo, desempenhando um papel na redução da glutationa, um importante antioxidante e um componente essencial necessário para a manutenção da estrutura normal das hemácias [17]. Antibióticos bactericidas, incluindo β-lactâmicos como a amoxicilina, demonstraram causar disfunção mitocondrial e espécies reativas de oxigênio (ROS), resultando em dano oxidativo [18]. Devido à apresentação tardia do paciente em nosso hospital, a confirmação direta da hemólise induzida por amoxicilina não foi possível; no entanto, nossos achados sugerem fortemente que a anemia hemolítica grave desse paciente foi possivelmente associada à exposição à amoxicilina. O estresse oxidativo (potencialmente como resultado da exposição à amoxicilina), que é um conhecido iniciador de hemólise em pacientes com deficiência de G6PD, pode ter sido grave o suficiente para produzir hemólise significativa e contínua, bem como hepatotoxicidade e esplenomegalia subsequente nesta apresentação de caso. Seria de particular interesse realizar testes de genotipagem de pacientes com deficiência de G6PD para definir variantes específicas de G6PD que poderiam determinar quais pacientes seriam especialmente suscetíveis à hemólise desencadeada por amoxicilina. Novos insights sobre os polimorfismos da G6PD podem fornecer algum esclarecimento e aludir melhor à suscetibilidade potencial daqueles pacientes que responderiam com uma hemólise grave após a exposição à amoxicilina.
Em conclusão, descrevemos uma apresentação incomum de anemia hemolítica grave, provavelmente relacionada à exposição à amoxicilina em um paciente com deficiência de G6PD. Esses achados, em conjunto com casos publicados anteriormente, destacam a necessidade de considerar a amoxicilina como causa dos sintomas apresentados neste relato de caso. O aumento da consciência de tal potencial justificaria cautela ao prescrever amoxicilina para pacientes com deficiência de G6PD e pode argumentar para caracterização adicional da variante precisa de G6PD, uma vez que uma deficiência tenha sido estabelecida.
Esse estudo foi baseado em uma “possibilidade” segundo os médicos. Mesmo diante de toda investigação feita, por não achar uma resposta plausiva, eles decidiram supor que foi a amoxicilina, baseado em muitas questões hematologicas não ligadas a Deficiência de G6PD em si, outro fator é o tempo de crise hemolitica, o paciente vez o uso do medicamento 10 dias antes da admisão ao hospital, bom, uma crise por contato com restrito ocorre de 24 a 72 hs dependendo do gatilho, outro ponto é o tempo que a crise hemolitica durou mais de 3 semanas mesmo ele não estando usando amaxicilina que foi o gatilho de hemólise suspeito e citado na investigação, outro ponto, os médicos usaram Ciplofaxacino medicamento restrito para Deficiência de G6PD para tratar o paciente.
O estudo em si, não valida nem comprova restrição de amoxicilina na deficiência de G6PD.
Acredito que antes de qualquer médico pensar na inclusão o medicamento nas restrições, é necessário não apenas mais estudos, mas também muitos pontos a se considerar, como o uso de larga escala da amoxicilina no Brasil que se de fato fosse restrito, levaria muitos pacientes deficiente de g6pd a crises hemoliticas constantes pelo uso, além de muitos adultos sendo diagnosticado com deficiência de g6pd por uma crise hemolitica por uso da amoxicilina, o que de fato não acontece.
Em fim, nenhuma lista fora do Brasil nunca inclui amoxicilina nas restrições, e mesmo no Brasil aparentemente até hoje só existe uma lista que inclui a amoxicilina nas restrições.
Quando o assunto é saúde das nossas crianças e as restrições eu sigo levando a aromaterapia como alternativa segura para nossas crianças, sendo tal medicamento restrito ou não, ter a possibilidade de aumentar a imunidade das nossas crianças e até mesmo tratar com uma opção natural e segura não tem preço!

