Associação entre deficiência de glicose-6-fosfato desidrogenase e asma
Abstrato
Introdução: Entre os determinantes que contribuem para a patogênese da asma, os fatores genéticos antioxidantes desempenham um papel de destaque. A glicose-6-fosfato desidrogenase (G6PD) é uma enzima competente para desintoxicar os radicais livres. Embora uma relação entre deficiência de G6PD e asma tenha sido relatada anteriormente, a literatura ainda é escassa. Neste estudo, testamos essa hipótese em uma grande coorte de pacientes da Sardenha, Itália. Métodos: Foi realizado um estudo retrospectivo de caso-controle com dados de 11.829 prontuários de pacientes ambulatoriais encaminhados a um hospital universitário para consulta médica. No total, 455 casos (asma positivo) e 11.374 controles (asma negativo) foram comparados quanto ao estado de G6PD usando análise multivariável, ajustando para todas as covariáveis. Resultados: No geral, a deficiência de G6PD foi detectada em 11,2% dos participantes do estudo e foi associada a um risco aumentado de asma (odds ratio (OR) 1,63; intervalo de confiança (IC) de 95% 1,27–2,10). Variáveis adicionais significativamente associadas à asma foram sexo feminino (OR 1,66; IC 95% 1,34–2,06), sobrepeso/obesidade (OR 1,56; IC 95% 1,27–1,92), tabagismo (OR 1,44; IC 95% 1,449–3,963) e alto nível socioeconômico (OR 1,40; IC 95% 1,16–1,70), enquanto a idade foi inversamente relacionada à asma (OR 0,49; IC 95% 0,39–0,61). Conclusões: Nosso estudo mostra que a deficiência de G6PD é um risco independente para asma. Esses achados sugerem que a G6PD deve ser avaliada em pacientes asmáticos para melhor estratificação de risco.
1. Introdução
A asma é uma doença inflamatória não transmissível das pequenas vias aéreas que afeta mais de 330 milhões de pessoas em todo o mundo [1]. A taxa de prevalência mostra diferenças entre países e estudos [2], variando de 0,2% na China a 21,0% na Austrália [3]. Embora a asma seja considerada a doença crônica mais comum entre as crianças, ela também pode afetar os adultos. Assim como outras doenças inflamatórias, a asma é mais prevalente em mulheres adultas em comparação com homens, embora a disparidade de gênero seja revertida na infância, onde a asma é mais frequente em meninos do que em meninas [4]. A fisiopatologia da asma é caracterizada pela inflamação persistente das pequenas vias aéreas com infiltração eosinofílica na lâmina própria da mucosa, levando à hiperresponsividade das vias aéreas a uma ampla variedade de estímulos exógenos e endógenos [5]. Consequentemente, os pacientes sofrem de sibilos e tosse, às vezes sofrendo uma incapacidade progressiva ao longo da vida.
Além dos eosinófilos da mucosa, células imunes adicionais também participam de doenças de longa duração. A exposição a alérgenos desencadeia a produção de anticorpos IgE específicos, levando à superexpressão da resposta de células T do tipo Th2. A IgE ligada a receptores de alta afinidade nas células dendríticas facilita a internalização do alérgeno; Uma vez dentro da célula dendrítica, o processamento dos alérgenos pela catepsina S e a posterior seleção dos peptídeos carregados e apresentados pelas moléculas HLA (MHC classe II) são etapas fundamentais para que essas células atuem como células apresentadoras de antígenos aos linfócitos T [6] . A apresentação de um peptídeo de antígeno selecionado ao receptor de células T induz a sensibilização e uma subsequente resposta imune ao alérgeno específico [7].
Dentre os fatores de risco envolvidos no desenvolvimento da asma, fatores dietéticos, ambientais e genéticos, capazes de reduzir a capacidade antioxidante celular por aumentar a vulnerabilidade tecidual ao estresse oxidativo, elevam o risco da doença. Por exemplo, a deficiência de selênio reduz a atividade da glutationa peroxidase nos glóbulos vermelhos e está associada ao aumento do risco de asma [8]. Da mesma forma, a baixa ingestão dietética de vitaminas C e E também parece aumentar o risco [9,10]. Fatores predisponentes adicionais são história familiar, fatores perinatais como tabagismo materno [11], idade, dieta e deficiência de vitamina D [12], presença de outras doenças atópicas, exposição materna e infantil a medicamentos como paracetamol [13], inibidores da bomba de prótons [14], certos antibióticos e exposição a bactérias e produtos bacterianos no início da vida. Além disso, foi sugerido que a obesidade abdominal aumenta o risco de desenvolver asma [15]. O principal fator de risco ambiental é o hábito de fumar, que parece alterar as proteínas da mucosa [16]. Embora a patogênese da asma permaneça indefinida, vários fatores genéticos podem interagir com fatores de risco ambientais para aumentar a inflamação e o dano tecidual causado pelo estresse oxidativo, promovendo o distúrbio.
Curiosamente, vários anos atrás, alguns estudos relataram um risco aumentado de desenvolver asma em indivíduos portadores de um defeito na glicose-6-fosfato desidrogenase (G6PD) [17,18]. No entanto, por várias décadas, o tema foi engavetado e, até o momento, a literatura sobre essa associação é escassa.
A G6PD é conhecida como a enzima limitante da via das pentoses fosfato [19]. A enzima produz nicotinamida adenina dinucleotídeo fosfato (NADPH), cofator essencial no metabolismo oxirredutor, mantendo uma alta proporção de glutationa reduzida/oxidada (GSH) e atuando como substrato para NADPH oxidase (NOX) e óxido nítrico sintase (NOS). A deficiência de G6PD é o defeito enzimático mais comum em todo o mundo, afetando 400 a 500 milhões de pessoas [20]. Indivíduos portadores de deficiência enzimática são geralmente assintomáticos, mas, em certas circunstâncias, podem apresentar anemia episódica. Após a exposição a favas, infecções ou medicamentos com alto potencial redox, incluindo anti-inflamatórios não esteroides, as hemácias mais velhas, onde o gradiente de deficiência de G6PD é maior, sofrem hemólise. Além disso, em recém-nascidos com deficiência de G6PD, a diminuição da excreção de bilirrubina pode resultar em icterícia. Mais recentemente, foi relatado que a deficiência de G6PD pode exercer um efeito pró-inflamatório dependendo do modelo animal ou humano e do tecido envolvido [21].
Na ilha da Sardenha, na Itália, a deficiência de G6PD é muito comum, por exemplo, cerca de 10-12% da população em geral [22]. Por outro lado, os dados de acordo com o Gender Environment Interactions in Respiratory Diseases (GEIRD) indicam um risco relativo de asma na Itália de 6,6 (IC 95% 6,1–7,1) e, mais especificamente, para Sassari (norte da Sardenha), um parente risco de 7,3 (IC 95% 6,0–8,8) [23]. Um estudo epidemiológico adicional no sul da Itália, incluindo Sardenha e Sicília, relatou uma prevalência de asma variando entre 2,6% e 3,2%, tornando a ilha o modelo ideal para testar a associação G6PD/asma [24].
Com base nessas premissas, procuramos avaliar a associação entre asma e Deficiência de G6PD em uma população definida do norte da Sardenha.
2. Materiais e métodos
2.1. Design de estudo
Este foi um estudo retrospectivo de caso-controle, de centro único, que aproveitou a disponibilidade dos registros clínicos de pacientes adultos ambulatoriais encaminhados a um hospital universitário do norte da Sardenha (Departamento de Medicina Interna, Universidade de Sassari), Itália, de janeiro de 2002 a Dezembro de 2019. Os pacientes foram encaminhados por seus médicos de família e/ou especialistas por qualquer motivo. Pacientes com asma foram considerados, e os controles foram pacientes sem asma.
2.2. Critério de eleição
Registros de informações pessoais como sexo, idade, tabagismo, situação socioeconômica, parâmetros antropométricos (altura e peso corporal), todos os sinais e sintomas, tratamentos e um histórico médico preciso foram considerados elegíveis para análise. Mais especificamente, para o propósito do estudo, a presença de asma foi recuperada do banco de dados computadorizado entre as condições previamente diagnosticadas. Além disso, o diagnóstico de asma obtido do prontuário do paciente foi verificado duas vezes, combinando o tratamento (por exemplo, corticosteroide inalatório ou corticosteroide inalatório misto, β2-agonista de longa duração na manutenção ou sob demanda, ou β2-agonista de ação curta quando necessário ), de acordo com o consenso da Global Initiative for Asthma (GINA) [25]. A disponibilidade do status G6PD foi considerada o principal critério de inclusão. Os dados de cada paciente foram coletados por meio de um formulário padrão durante todo o período do estudo, e cada visita foi supervisionada pelo mesmo médico assistente.
2.3. Critério de exclusão
Prontuários incompletos ou de pacientes menores de 18 anos não foram incluídos na análise. No caso de várias consultas para o mesmo paciente dentro do período de tempo determinado, apenas a mais recente foi considerada para análise.
2.4. Critério de diagnóstico
Estado G6PD. Como a Sardenha é uma região de alta prevalência de deficiência de G6PD, os indivíduos são avaliados rotineiramente quanto ao status de G6PD, especialmente antes da exposição a certos medicamentos. A atividade da G6PD no sangue total foi medida usando um método padrão, conforme descrito anteriormente [26,27]. Menos de 10% da atividade residual foi usada para definir a presença de deficiência total de G6PD, enquanto a atividade residual variando de 10% a 50% foi usada para definir a deficiência parcial. A análise molecular não estava disponível para pacientes com deficiência de G6PD.
Diagnóstico de asma. A asma é uma condição obstrutiva crônica caracterizada tanto pelo componente inflamatório quanto pela obstrução das vias aéreas, podendo ser espontânea ou induzida por diversos gatilhos, diferente da doença pulmonar obstrutiva crônica (DPOC), que tipicamente apresenta obstrução brônquica fixa. A medida da função pulmonar avaliada pela espirometria é considerada o padrão ouro para o diagnóstico de asma [28]. De acordo com as diretrizes da European Respiratory Society e da American Thoracic Society (ERS/ATS), uma relação entre o volume expiratório forçado no primeiro segundo (VEF1) e a capacidade vital forçada (CVF) menor que 0,7 é o ponto de corte usado para diagnosticar uma doença obstrutiva padrão respiratório, enquanto o consenso da GINA sugere um ponto de corte de 0,8 [25]. Para estabelecer se a obstrução brônquica é permanente ou temporária, utiliza-se o teste de reversibilidade farmacológica. O teste é realizado repetindo a espirometria após a inalação de um β2-agonista de início rápido, como o salbutamol [25,28]. O teste é considerado positivo se houver aumentos de VEF1 de 200 mL ou aumentos de VEF1 ou CVF de 12% do valor basal [29]. Uma história de sibilância, tosse e aperto no peito pode ser sugestiva da doença, especialmente quando há história familiar positiva de asma.
2.5. Considerações éticas
O protocolo foi aprovado pelo Comitê de Ética local (Comitato di Bioetica, Azienda Ospedaliero-Universitaria di Sassari, Itália) (Protocolo nº 3004/CE, 2016).
2.6. Análise estatística
As distribuições de idade, sexo, nível socioeconômico (SES), índice de massa corporal (IMC) e hábito de fumar foram comparadas descritivamente entre casos e controles. Mais especificamente, a idade foi recodificada em uma variável binária por divisão na idade de 60 anos. O status socioeconômico foi estimado usando a ocupação atual ou passada e dividido em quatro categorias, da classe I (a mais alta) à classe IV (a mais baixa), conforme relatado anteriormente [30], e expresso como uma variável binária: (i) NSE alto ( classes I e II) e (ii) NSE baixo (classes III e IV). O IMC foi calculado pela fórmula peso (kg)/altura (m2), e sobrepeso/obesidade foi definido como IMC > 25 kg/m2. Em relação ao hábito de fumar, os pacientes foram estratificados como nunca ou fumantes atuais/ex-fumantes. Os pacientes com deficiência total e parcial de G6PD foram agrupados.
A regressão logística univariada e multivariada foi usada para examinar a associação da asma com o status G6PD calculando as razões de chances (ORs) e seus intervalos de confiança (IC) de 95% usando a fórmula de Wald: IC 95% = OR1±(β/SE). O efeito principal das variáveis foi avaliado primeiro inserindo as covariáveis uma a uma e depois simultaneamente (o modelo ajustado). Além disso, os pacientes com asma foram estratificados de acordo com a classificação GINA, com base nos sintomas da asma e na terapia, a fim de verificar a frequência da deficiência de G6PD em cada subgrupo (asma intermitente, persistente leve, persistente moderada e persistente grave).
Todas as análises estatísticas foram realizadas com o software estatístico SPSS (versão 22.0, Chicago, IL, EUA), e valores de p bilateral inferiores a 0,05 foram considerados estatisticamente significativos.
3. Resultados
Um total de 11.829 prontuários de pacientes (7.323 mulheres, 61,9%) que passaram por consulta médica estavam disponíveis para análise. As estatísticas descritivas da população estudada são relatadas na Tabela 1.
A prevalência de asma entre os participantes do estudo foi de 3,8%, de acordo com um relatório anterior [24]. Os asmáticos eram significativamente mais jovens do que os não asmáticos (asma: 49,1 ± 17,1 vs. não asmáticos: 55,2 ± 18,0 anos; p < 0,0001). Como esperado, a prevalência de asma foi maior entre as mulheres em comparação com os homens (4,3 vs. 3,1, p = 0,001).
Indivíduos com baixo NSE foram menos no grupo asmático (3,3% vs. 4,7%, p < 0,0001). O sobrepeso/obesidade (≥25 kg/m2) foi mais comum entre os asmáticos, embora essa diferença não tenha alcançado significância estatística (Tabela 1). A proporção de fumantes ou ex-fumantes foi significativamente maior entre os asmáticos (4,8% vs. 3,5%, p = 0,003). Com base nos dados laboratoriais retirados dos prontuários dos participantes, 1.319 pacientes (11,2%) eram parcial ou totalmente deficientes em G6PD, com maior frequência entre as mulheres (13,4%) do que entre os homens (7,7%), de acordo com o sexo. traço vinculado. Curiosamente, a proporção de asmáticos foi maior entre os pacientes com deficiência de G6PD do que entre os pacientes com atividade enzimática normal (5,8% vs. 3,6%, p < 0,0001) tanto em homens (6,4%) quanto em mulheres (4,3%).
A proporção de asma diminuiu nos pacientes em relação à idade, como mostra a Figura 1.
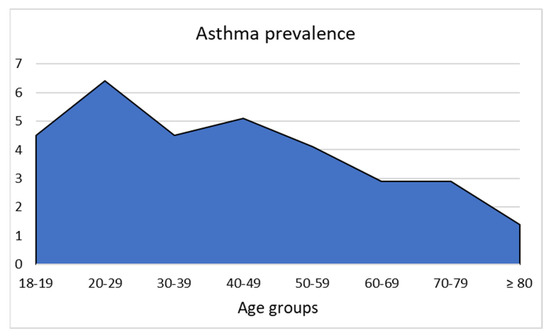
Figura 1. Prevalência de asma entre os participantes do estudo, estratificada por faixas etárias.
Na Tabela 2, o risco de ocorrência de asma é listado de acordo com sexo e idade em pacientes normais e deficientes em G6PD.
Tabela 2. Risco de asma segundo sexo e idade em indivíduos normais e deficientes em G6PD.
O risco não ajustado de asma foi significativamente maior do que a unidade entre os pacientes com deficiência de G6PD (1,69, IC 95% 1,31–2,17).
O aumento do risco de asma entre indivíduos com deficiência de G6PD foi observado em ambos os sexos, embora a significância estatística tenha sido alcançada apenas no subgrupo feminino. Mais especificamente, observou-se uma tendência crescente nas várias faixas etárias; a tendência alcançou significância no grupo de 60‐79 anos (ANOVA, p < 0,0001) (Figura 2).
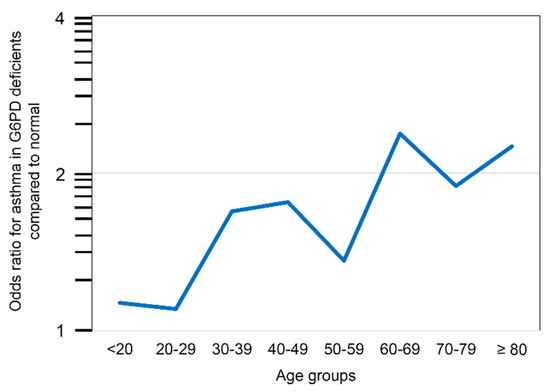
Figura 2. Risco de asma em pacientes com deficiência de G6PD em comparação com pacientes sem deficiência de acordo com as décadas de idade.
Notavelmente, embora o risco absoluto de asma estivesse inversamente relacionado à idade, em indivíduos com deficiência de G6PD em comparação com indivíduos normais, o risco de asma aumentou de maneira dependente da idade (Figura 2) e atingiu um máximo após os 60 anos (OR 2,21, IC 95% 1,43–3,40) (Tabela 2).
A Tabela 3 relata a análise de regressão logística univariada e multivariada para a associação do status G6PD com asma, ajustando para covariáveis. A deficiência de G6PD aumentou significativamente o risco no modelo não ajustado (1,69, IC 95% 1,31–2,17), permanecendo significativo após o ajuste para sexo, idade, NSE, IMC e tabagismo (1,63, IC 95% 1,27–2,10).
Tabela 3. Análise de regressão logística para o status G6PD e outras variáveis potencialmente associadas ao risco de asma.
A Tabela 4 relata o estado G6PD de acordo com a gravidade do fenótipo da asma. Em comparação com os participantes do estudo sem asma, houve uma tendência a frequências mais altas de deficiência de G6PD entre os participantes com níveis de asma de maior gravidade, o que foi estatisticamente significativo para asma persistente moderada.
Tabela 4. A gravidade da asma com base na classificação da Global Initiative for Asthma (GINA) de acordo com o status da glicose-6-fosfato desidrogenase (G6PD).
Como os esteróides podem inibir a atividade da G6PD, pelo menos em modelos animais [31], existe a possibilidade teórica de que pacientes asmáticos possam ter uma deficiência enzimática devido à terapia. No entanto, como pode ser visto na Tabela 4, a frequência de deficiência de G6PD em pacientes com a forma mais grave de asma, expostos a esteróides sistêmicos, foi semelhante à da população normal.
4. Discussão
No presente estudo, conduzido em uma coorte de indivíduos encaminhados ao Departamento de Medicina de Sassari, Itália, foi encontrada uma associação significativa entre a deficiência hereditária de G6PD e o risco de asma. Essa associação, relatada pela primeira vez há mais de três décadas [17,18], por muitos anos, não atraiu interesse suficiente dos investigadores por dois prováveis motivos principais. Primeiro, as populações com maior prevalência de deficiência de G6PD vivem principalmente em países com poucos recursos e, portanto, estão menos expostas a fatores ambientais estressantes, como a poluição [32]. Uma segunda razão pode ser que, até muito recentemente, a enzima era considerada crucial apenas para as hemácias, que dependem inteiramente do PPP para a manutenção da capacidade redutora, enquanto outros tipos de células possuem fontes alternativas de NADPH [33]. Na realidade, a expressão da enzima é alta em leucócitos e outras células imunes [34] e, recentemente, descobriu-se que a deficiência de G6PD está envolvida em vários distúrbios além das doenças do sangue, incluindo sepse [35], hiperbilirrubinemia neonatal [36] , e doenças cardiovasculares [37], especialmente em idosos [38].
Entre os sardos, há uma prevalência de cerca de 10-12% [22], essencialmente determinada por uma mutação fundadora (G6PD Med, S188F) em mais de 95% dos indivíduos deficientes. A atividade residual de G6PD Med é inferior a 10% em homens hemizigóticos e mulheres homozigóticas e entre 10% e 50% em mulheres heterozigóticas. Portanto, essa população é um modelo ideal para testar a hipótese da associação G6PD/asma com grau adequado de poder estatístico.
Os resultados obtidos neste estudo fornecem evidências convincentes de que indivíduos com deficiência hereditária de G6PD são propensos a desenvolver asma com mais frequência do que indivíduos com atividade enzimática normal, independentemente do sexo, SSE, hábito de fumar e excesso de peso. O risco aumentado foi observado principalmente em indivíduos mais velhos, atingindo significância estatística na faixa etária de 60 a 79 anos. A associação provavelmente persiste também em idades posteriores, mas o pequeno número de asmáticos mais velhos na coorte da amostra examinada não permitiu que essa hipótese fosse testada com poder estatístico suficiente. Esta descoberta sugere que indivíduos com deficiência de G6PD podem experimentar defesa antioxidante progressivamente prejudicada, colocando-os em maior risco de desenvolver asma na presença de fatores predisponentes, incluindo o envelhecimento. A mesma associação pode existir em crianças, embora, neste estudo, não tenha sido avaliada.
O principal mecanismo patogenético da asma é devido à inflamação crônica, em grande parte impulsionada pela resposta imune inata. Espécies reativas de oxigênio (ROS) são poderosos mediadores da resposta inflamatória, e o aumento da produção ou diminuição do nível de neutralização de ERO desempenha um papel importante na patogênese da asma.
Em um estudo com o objetivo de identificar proteínas diferencialmente expressas no soro de crianças com e sem asma, G6PD foi significativamente diminuído em crianças asmáticas [39], sugerindo que a deficiência enzimática pode aumentar as ERO, desencadeando vias de quinase que são capazes de facilitar a transmissão viral. replicação e, por sua vez, agravando a lesão das vias aéreas. Um estudo adicional realizado em uma coorte pediátrica usando a técnica de perfilamento de microarray identificou o gene G6PD entre os três primeiros genes expressos diferencialmente dos 274 genes associados à asma [40]. A deficiência de G6PD pode aumentar o risco de infecções, incluindo as do trato respiratório [41], que estão implicadas na etiologia da asma. Sabe-se que células in vitro com knockdown de G6PD são mais suscetíveis a infecções virais [42], e durante a recente pandemia de COVID-19, a deficiência de G6PD foi vista como um fator agravante no quadro clínico e prognóstico [37]. Pode-se, portanto, levantar a hipótese de que crianças com deficiência de G6PD apresentam infecções virais e/ou bacterianas com mais frequência, abrindo caminho para hiper-reatividade subsequente.
Além das infecções, um papel fundamental na patogênese da asma é desempenhado pelo estresse oxidativo; isso é apoiado por estudos experimentais e clínicos, por exemplo, aqueles focados na exposição a oxidantes fortes como o ozônio [43,44]. A atividade de G6PD aumenta após a administração intravenosa de ozônio em humanos [45,46], bem como em macrófagos alveolares em modelos de camundongos expostos ao ozônio [47]. Curiosamente, Varghese et al. demonstraram que a deficiência enzimática influencia os fluxos metabólicos e a hipertensão pulmonar em uma linhagem de camundongos [48].
Uma das principais funções da G6PD é regenerar o tiol GSH reduzido consumido durante a neutralização de ROS [49]. Em modelos experimentais de asma, o GSH é significativamente diminuído em comparação com os controles, apoiando o papel central dos mecanismos antioxidantes intracelulares neste distúrbio [50]. Além disso, na asma humana, o nível de GSH reduzido é significativamente aumentado, indicando uma função reparadora [51]. Assim, é razoável especular que indivíduos com deficiência de G6PD podem ter produção insuficiente de NADPH para manter estoques adequados de GSH em pacientes com asma (Figura 3).
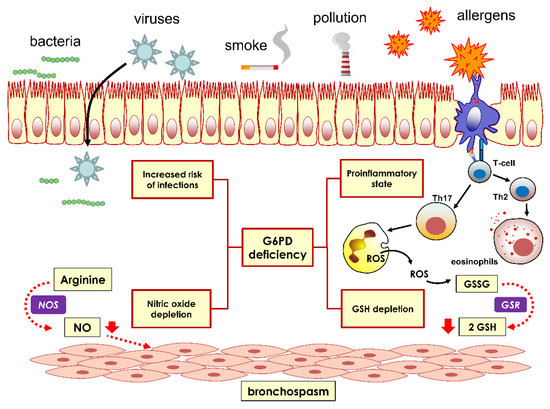
Figura 3. O suposto papel da deficiência de G6PD na patogênese da asma. A produção de óxido nítrico (NO) relaxa a musculatura lisa das vias aéreas e vasos, induzindo broncodilatação e vasodilatação. A deficiência de G6PD induz broncoconstrição ao diminuir a geração de NO pela óxido nítrico sintase (NOS). Além disso, a deficiência de G6PD causa diminuição da depleção de glutationa (GSH), diminuindo assim a defesa antioxidante e aumentando a geração de radicais livres.
Além disso, a deficiência de G6PD causa a depleção de óxido nítrico (NO) [52]. Este composto, sendo ao mesmo tempo uma importante molécula sinalizadora e um radical livre, tem um efeito duplo: em níveis baixos, tem principalmente um papel relaxante muscular das vias aéreas e, em níveis elevados, ativa mecanismos pró-inflamatórios; portanto, na asma, o efeito da depleção de NO é complexo e, na G6PD grave, uma deficiência pode ser tanto benéfica quanto adversa. Pode-se conjeturar que a depleção crônica de NO, decorrente da deficiência de G6PD, possa afetar o tônus broncodilatador basal sustentado por essa molécula [53]. Mais importante ainda, a depleção de NO manifesta seu efeito, principalmente em idosos, onde há comprometimento progressivo dos mecanismos antioxidantes [54]; talvez isso possa explicar em parte porque, em nosso estudo, a magnitude da associação da deficiência de G6PD com asma foi maior em pacientes após os 60 anos (Figura 3).
Finalmente, a deficiência de G6PD está associada a um estado pró-inflamatório ou à exacerbação de um estado pró-inflamatório [21]. Recentemente, um número crescente de estudos relatou que a deficiência de G6PD altera vias específicas de citocinas envolvidas em vários distúrbios. Por exemplo, um modelo in vitro baseado em células HepG2 de hepatocarcinoma humano, no qual G6PD foi inativado por siRNA, revelou um aumento na produção de neutrófilos quimioatraentes interleucina-8 (IL-8), que foi espelhado por uma produção aumentada de espécies reativas de oxigênio [ 55]. No nível molecular, o mecanismo foi investigado em detalhes e envolve a ativação da via de sinalização NF-κB. Níveis séricos aumentados de IL-8, bem como IL-4, IL-5 e IL-9 foram relatados na hiper-reatividade da asma após a liberação de linfócitos Th2 [56]. Portanto, indivíduos com deficiência de G6PD podem experimentar superexpressão de IL-8 e quimiotaxia aumentada de eosinófilos e outras células inflamatórias, que são encontradas em abundância no escarro ou no líquido de lavagem broncoalveolar. Além disso, como a secreção de TGF-β foi encontrada aumentada em macrófagos deficientes em G6PD [57], isso pode ser um fator agravante do estado inflamatório (Figura 3).
A associação da asma com o gene G6PD, que mapeia no cromossomo X (OMIM 305900), poderia teoricamente ser devido a uma ligação com um gene predisponente localizado próximo ao locus G6PD. O candidato mais interessante é provavelmente o gene do receptor de cisteinil leucotrieno 1 (CYSLTR1), localizado no cromossomo Xq21.1 [58], que tem sido implicado em vários distúrbios alérgicos, incluindo a asma [59]. No entanto, a distância relativa entre os dois loci não exclui totalmente a possibilidade de eventos de recombinação, tornando essa hipótese fraca e fortalecendo implicitamente um papel patogenético direto do próprio gene G6PD.
Algumas limitações deste estudo precisam ser mencionadas. Primeiro, sendo um estudo retrospectivo, não podemos excluir que potenciais fatores de confusão possam ser distribuídos de forma diferente entre casos e controles. No entanto, dado o grande número de participantes, estamos confiantes de que a extensão de tal viés seria minimizada. Uma limitação adicional de nosso estudo pode ser a falta de genotipagem molecular para pacientes com deficiência de G6PD identificada bioquimicamente, impossibilitando, no caso de mulheres, distinguir homozigotos de heterozigotos e, portanto, testar a associação de asma com G6PD total ou parcial deficiência separadamente. No entanto, do ponto de vista clínico, a falta de uma análise mais detalhada não teria alterado os achados gerais.
5. Conclusões
Em conclusão, em nosso estudo, descobrimos que a deficiência de G6PD foi associada a um risco aumentado de asma, e esse risco permaneceu significativo após o ajuste para variáveis tradicionais bem conhecidas, como sexo feminino, sobrepeso/obesidade e NSE elevado. Esses achados sugerem que a G6PD deve ser avaliada em pacientes com asma para melhor estratificação de risco.
Contribuições do autor
Conceitualização, M.P.D. e G.M.P.; metodologia, G.M.P.; software, G.M.P.; validação, M.P.D., A.F. e G.M.P.; análise formal, G.M.P.; investigação, A.F., A.M., V.S., P.P. e MPD; recursos, A.F.; curadoria de dados, G.M.P.; redação—preparação do rascunho original, M.P.D.; redação – revisão e edição, A.F., P.P., M.P.D. e G.M.P.; visualização, G.M.P.; supervisão, M.P.D.; administração de projetos, M.P.D.; aquisição de financiamento, A.F. Todos os autores leram e concordaram com a versão publicada do manuscrito.
Financiamento
Esta pesquisa não recebeu financiamento externo.
Declaração do Conselho de Revisão Institucional
O estudo foi conduzido de acordo com as diretrizes da Declaração de Helsinque e aprovado pelo Comitê de Ética local (Comitato di Bioetica, Azienda Ospedaliero-Universitaria di Sassari, Itália) (Protocolo nº 3004/CE, 2016).
Declaração de Consentimento Informado
O consentimento informado foi obtido de todos os indivíduos envolvidos no estudo.
Declaração de Disponibilidade de Dados
Os dados apresentados neste estudo estão disponíveis a pedido do autor correspondente.
Leia o Artigo Original Completo AQUI
References
- The Global Asthma Report. Available online: http://globalasthmareport.org/resources/Global_Asthma_Report_2018.pdf (accessed on 29 October 2021).
- 2D’Amato, G.; Holgate, S.T.; Pawankar, R.; Ledford, D.K.; Cecchi, L.; Al-Ahmad, M.; Al-Enezi, F.; Al-Muhsen, S.; Ansotegui, I.; Baena-Cagnani, C.E.; et al. Meteorological Conditions, Climate Change, New Emerging Factors, and Asthma and Related Allergic Disorders. A Statement of the World Allergy Organization. World Allergy Organ. J. 2015, 8, 25. [Google Scholar] [CrossRef][Green Version]
- To, T.; Stanojevic, S.; Moores, G.; Gershon, A.S.; Bateman, E.D.; Cruz, A.A.; Boulet, L.P. Global Asthma Prevalence in Adults: Findings from the Cross-Sectional World Health Survey. BMC Public Health 2012, 12, 204. [Google Scholar] [CrossRef][Green Version]
- Ridolo, E.; Incorvaia, C.; Martignago, I.; Caminati, M.; Canonica, G.W.; Senna, G. Sex in Respiratory and Skin Allergies. Clin. Rev. Allergy Immunol. 2019, 56, 322–332. [Google Scholar] [CrossRef]
- Holgate, S.T. Pathogenesis of Asthma. Clin. Exp. Allergy 2008, 38, 872–897. [Google Scholar] [CrossRef] [PubMed]

