Impacto da deficiência de glicose-6-fosfato desidrogenase na infecção por dengue em crianças de Mianmar.
Author information
Affiliations
- 4 authors1. Department of Clinical Tropical Medicine, Faculty of Tropical Medicine, Mahidol University, Bangkok, Thailand.
- 1 author2. Department of Medical Research, Yangon, Myanmar.
- 3 authors3. Mahidol-Oxford Tropical Medicine Research Unit, Faculty of Tropical Medicine, Mahidol University, Bangkok, Thailand.
- 1 author4. Department of Paediatrics, University of Medicine 2, Yangon, Myanmar.
- 1 author5. Korea University, Guro Hospital, Seoul, Korea.
- 1 author6. Department of Tropical Hygiene, Faculty of Tropical Medicine, Mahidol University, Bangkok, Thailand.
ORCIDs linked to this article
- Jittamala P,0000-0002-1020-2760
- Thaipadungpanit J,0000-0002-6184-3381, Mahidol University Faculty of Tropical Medicine
- Althaus T,0000-0002-6997-3877, Centre Scientifique de Monaco
Plos one, 02 Jan 2019, 14(1):e0209204
DOI: 10.1371/journal.pone.0209204 PMID: 30601843 PMCID: PMC6314580
Abstrato
A deficiência de glicose-6-fosfato desidrogenase (G6PD) pode afetar a apresentação clínica da dengue devido ao estado redox alterado nas células imunes. Nosso objetivo foi determinar a associação entre a deficiência de G6PD e a gravidade da infecção por dengue em pacientes pediátricos em Mianmar. Um estudo transversal foi conduzido entre pacientes pediátricos de 2 a 13 anos com dengue no Yankin Children Hospital, Myanmar. Cento e noventa e seis pacientes positivos para infecção por dengue, conforme determinado por PCR ou ELISA, foram incluídos. A gravidade da dengue foi determinada de acordo com as diretrizes de classificação da OMS de 2009. Ensaios espectrofotométricos determinaram os níveis de G6PD. O valor médio ajustado de G6PD de homens na população do estudo foi usado para definir vários pontos de corte de acordo com as diretrizes de classificação da OMS. A genotipagem G6PD para as mutações Mahidol, Kaiping e Mediterranean foi realizada em 128 das 196 amostras por PCR multiplex em tempo real. 51 de 196 (26,0%) pacientes apresentavam dengue grave. A prevalência de deficiência do fenótipo G6PD (< 60% de atividade) em pacientes pediátricos foi de 14,8% (29/196), especificamente, 13,6% (14/103) em homens e 16,2% (15/93) em mulheres. Deficiência grave (< 10% de atividade) representou 7,1% (14/196) de nossa coorte, ocorrendo 11,7% (12/103) em homens e 2,2% (2/93) em mulheres. Entre 128 amostras genotipadas, as mutações do gene G6PD foram detectadas em 19,5% (25/128) dos pacientes, sendo 20,3% (13/64) em homens e 18,8% (12/64) em mulheres. A mutação G6PD Mahidol foi de 96,0% (24/25), enquanto a mutação G6PD Kaiping foi de 4,0% (1/25). A dengue grave não foi associada à deficiência da enzima G6PD ou à presença da mutação do gene G6PD. Assim, nenhuma associação entre a deficiência de G6PD e a gravidade da dengue pode ser detectada. Registro do estudo: O estudo foi registrado de acordo com a Plataforma Internacional de Registro de Ensaios Clínicos da OMS (OMS-ICTRP) no site do Registro de Ensaios Clínicos da Tailândia (TCTR), número de registro # TCTR20180720001.
Introdução
A glicose-6-fosfato desidrogenase (G6PD) é uma enzima presente no citoplasma de células humanas que participa da via das pentoses fosfato e fornece energia redutora pela manutenção dos níveis da coenzima nicotinamida adenina dinucleotídeo fosfato (NADPH) [1]. A deficiência de G6PD é uma herança ligada ao cromossomo X. O gene G6PD consiste em 13 exons com aproximadamente 18kb e está situado no braço longo distal do cromossomo X (Xq28). Cerca de 180 mutações do gene G6PD foram relatadas, resultando em variantes de proteínas com diferentes níveis de atividade enzimática. O NADPH é essencial para os sistemas oxidante e antioxidante das células. Na via antioxidante, o NADPH mantém a forma reduzida da glutationa para proteger as células do dano oxidativo [2]. Essa redução nas células causa acúmulo de espécies oxidativas redox (ROS) e leva à senescência [1] e hemólise nas hemácias [3]. Por outro lado, o NADPH também está envolvido na via oxidante para produzir ERO. Embora a superprodução dessas ROS possa afetar adversamente a função celular, as células do sistema imunológico também precisam dessas espécies reativas para matar organismos invasores. Os fagócitos do sistema imunológico precisam dessas espécies reativas para matar patógenos invasores como parte do sistema imunológico inato. Em casos de deficiência grave de G6PD, a falta de metabolismo oxidativo pode causar uma redução na fagocitose dependente de oxigênio, como observado na doença granulomatosa crônica [4] e permite a replicação viral [5-8].
A deficiência de glicose-6-fosfato desidrogenase (G6PD) afeta mais de 400 milhões de pessoas em todo o mundo [9] e a prevalência é de aproximadamente 35% na África e varia de 6,0 a 10,8% no sudeste da Ásia [10]. Em Mianmar, a prevalência é de 11,1% e 4,2% em homens e mulheres adultos, respectivamente [11], enquanto é de 15,0% e 2,1% em crianças saudáveis, homens e mulheres, respectivamente [12]. Para observar, 11,8% dos homens e 21,0% das mulheres possuem a mutação G6PD [13] com a variante G6PD Mahidol ocorrendo em 91,3% das crianças em Mianmar [14].
A infecção pelo vírus da dengue é uma das principais causas de morbidade e mortalidade em crianças que vivem em regiões tropicais e subtropicais [15]. Segundo a OMS, aproximadamente 390 milhões de pessoas em todo o mundo experimentam uma infecção por dengue anualmente [16]. No sudeste da Ásia, a dengue leva a mais de 5.900 mortes anualmente [17]. Em Mianmar, sabe-se que todos os quatro sorotipos de dengue co-circulam, e as crianças correm o maior risco de infecção [18]. A taxa de letalidade relatada foi de 7 por 1.000 casos de dengue em 2014 [19].
A maioria dos pacientes com dengue apresenta-se com doença febril indiferenciada que alguns podem progredir para doença com risco de vida [20]. Como o histórico genético dos pacientes afeta o desenvolvimento de infecções graves tornou-se uma área de interesse. A deficiência de G6PD é uma das variantes genéticas relatadas associadas a infecções [8, 21]. Estudos in vitro relataram que os monócitos de indivíduos deficientes em G6PD apresentaram maior suscetibilidade a infecções pelo sorotipo 2 do vírus da dengue, juntamente com maior replicação viral [5, 6]. Ainda não se sabe se a maior replicação do vírus da dengue em indivíduos com deficiência de G6PD aumenta a probabilidade de gravidade da doença. Aqui, investigamos a associação entre a deficiência de G6PD e a gravidade da infecção por dengue em pacientes pediátricos em Mianmar.
Materiais e métodos
Recrutamento de pacientes e coleta de amostras
Um estudo prospectivo transversal foi realizado no Yankin Children Hospital, Yangon, de agosto de 2015 a agosto de 2016. Pacientes pediátricos (faixa etária: 2 a 13 anos) com febre por 1 a 7 dias e suspeita clínica de dengue foram triados. O consentimento informado por escrito e o consentimento verbal foram obtidos dos cuidadores e das crianças, respectivamente. Três mililitros de sangue foram coletados e os soros foram testados para o antígeno NS1, bem como para anticorpos IgM e IgG usando o teste de diagnóstico rápido SD BIOLINE Dengue Duo (RDT) (Standard Diagnostics, Coréia). Pacientes com antígeno NS1 positivo e/ou resultado IgM de dengue foram incluídos. Foram excluídos pacientes com diagnóstico diferente de dengue, como coinfecções e estado imunocomprometido (por exemplo, uso de esteroides, quimioterapia e/ou estado positivo para HIV). Os pacientes foram acompanhados 1–3 semanas após a admissão para coleta de amostra de soro convalescente. Hemograma completo (CBC), contagem de reticulócitos (RC) e atividade de G6PD foram medidos dentro de 24 horas após a coleta de soros agudos. A atividade da G6PD foi avaliada por espectrofotometria (Randox Laboratory, Reino Unido). O valor mediano ajustado da atividade de G6PD para homens em nossa coorte foi usado para definir vários pontos de corte [22]. A gravidade da dengue foi classificada de acordo com as diretrizes de classificação da OMS de 2009 [23]. Ambas as amostras agudas e convalescentes foram armazenadas a -80°C antes de testes adicionais.
A atividade de G6PD, hemograma e RC foram verificados novamente pelo menos um mês após a primeira coleta de amostra para pacientes com risco de serem diagnosticados erroneamente para deficiência de G6PD com base nas análises da primeira amostra de sangue coletada, como pacientes com valores de RC > 2%, aqueles que sofreram ou se recuperaram de anemia hemolítica aguda e aqueles que receberam transfusão de sangue antes da primeira coleta de amostra.
O protocolo do estudo foi aprovado pelo Comitê de Ética do Departamento de Pesquisa Médica, Mianmar (aprovação número 64/Ética 2015) e pelo Comitê de Ética da Faculdade de Medicina Tropical, Mahidol University, Tailândia (número de aprovação 2016-0808-01 ). O estudo também foi registrado seguindo a Plataforma Internacional de Registro de Ensaios Clínicos da OMS (OMS-ICTRP) no site Thai Clinical Trials Registry (TCTR), número # TCTR20180720001.
teste de referência
teste de dengue
A infecção por dengue foi confirmada por RT-PCR quantitativo em tempo real e antígeno NS1, IgM e IgG ELISAs na Mahidol Oxford Research Unit, Tailândia. Vírus da dengue NS1 ELISA (Cat. 11EK50, Standard Diagnostics Inc., Coréia do Sul), vírus da dengue IgM ELISA (Cat. 11EK20, Standard Diagnostics Inc., Coréia do Sul) e vírus da dengue IgG ELISA (Cat. Diagnostics Inc., Coreia do Sul) foram todos realizados de acordo com as instruções do fabricante.
Detecção dos vírus da dengue, zika e chikungunya usando um ensaio de PCR por transcriptase reversa
O RNA foi isolado de amostras de soro de pacientes agudos (140 μL) usando o QIAamp Viral RNA Mini Kit (Qiagen, Alemanha). As extrações de RNA foram realizadas de acordo com o protocolo do fabricante. O ARN foi armazenado a -80°C até utilização posterior. A PCR de transcriptase reversa (RT) em uma etapa foi realizada para detectar os vírus da dengue, zika e chikungunya em um único ensaio usando ZDC Multiples RT-PCR Assay (Bio-Rad, EUA). Os ensaios foram realizados de acordo com o protocolo do fabricante, com uma mistura adicional de primers de RNase P3 como controle interno de extração. Para cada ensaio de RT-PCR, um controle positivo, fornecido pelo kit; controle negativo (soro de doador saudável); e nenhum controle de modelo foi incluído. Todas as amostras de RNA foram realizadas em duplicata. Uma PCR positiva foi definida como quando uma ou ambas as duplicatas tinham um sinal acima de um limite fixo de 200 para todos os respectivos alvos: FAM para vírus zika, HEX para vírus chikungunya e Texas Red para vírus dengue.
Atividade G6PD
A amostra foi armazenada a 4–8°C, depois transportada para o laboratório do Departamento de Pesquisa Médica (DMR) em Yangon Myanmar e processada em 24 horas. A espectrofotometria foi realizada usando o espectrofotômetro Humalyser 3000 (Medsource Ozone Biomedicals, Delhi, Índia) e kits da Randox (Cat no PD 410, Randox Laboratories Ltd., Crumlin, Reino Unido). O procedimento fornecido no manual do kit foi seguido. Controles G6PD normais e deficientes (Cat no PD 2617 para deficiente e Cat no PD 2618 para normal, Randox Laboratories Ltd., Crumlin, Reino Unido) foram usados. Os resultados foram considerados válidos se as atividades medidas dos controles estivessem dentro do intervalo de referência. A atividade enzimática foi determinada pelo espectrofotômetro ajustado a 37°C para medir a taxa de absorção a 340 nm sob luz ultravioleta. A atividade enzimática foi calculada e ajustada para o valor da concentração de Hb do hemograma completo (CBC) registrado no momento da coleta da amostra. O valor mediano ajustado da atividade de G6PD para homens em nossa coorte foi usado para definir vários pontos de corte [22].
Genotipagem de G6PD por PCR em tempo real
As amostras de DNA foram extraídas de 200 μL de sangue total usando o QIAamp DNA Blood Mini Kit (Qiagen, Germany) de acordo com a recomendação do fabricante. Três variantes de G6PD (G6PD Mahidol c.487G>A; G6PD Kaiping c.1388G>A; e G6PD Mediterrâneo c.563C>T) relatadas anteriormente em indivíduos com deficiência de G6PD em Mianmar foram detectadas por PCR em tempo real com o BIO-RAD CFX 96 Real-Time System e Termociclador C1000 (Bio-Rad, EUA). A PCR de genotipagem, com análise da curva de fusão usando sondas duplamente marcadas e auto-extintas, foi realizada usando 25 μL de reações, contendo 12,5 μL de iQ Multiplex Power Mix, 0,75 μL cada de primers direto e reverso, 0,5 μl cada de sondas SNP e WT , 9 μL de água destilada estéril e 1 μL de DNA genômico. As condições de amplificação foram 3 minutos a 95°C para a atividade iQ Multiplex Power Mix, seguido de 40 ciclos de 15 segundos a 95°C para desnaturação e 1 minuto a 70°C para anelamento e extensão para genotipagem G6PD. As amostras foram processadas junto com o controle de plasmídeo para cada mutação alvo; três reações de PCR separadas foram executadas em cada amostra para as três mutações diferentes. Os valores de fluorescência e Ct usando o software CFX Manager (Bio-Rad, EUA) foram usados para determinar os genótipos. O resultado de cada amostra foi verificado examinando a curva de PCR gerada para eliminar resultados falso-positivos devido à emissão de luz aberrante (Tabela S1).
Definições de caso
Infecção aguda por dengue
A infecção aguda por dengue confirmada laboratorialmente foi definida por um resultado positivo de qRT-PCR, antígeno NS1 (Ag) ELISA ou IgM ELISA. As infecções primárias ou secundárias por dengue foram definidas de acordo com um resultado IgG ELISA negativo ou positivo na fase febril (≤ 7 dias), respectivamente [24].
Gravidade da dengue
A gravidade da infecção por dengue foi classificada de acordo com a diretriz da OMS de 2009 [23]. Os pacientes com dengue foram classificados como não graves ou graves com base em parâmetros clínicos e laboratoriais. Os pacientes com dengue não grave foram classificados em dois grupos com base na ausência ou presença de sinais de alerta. Dengue não grave sem sinais de alerta foi definido se o paciente apresentou febre com 2 dos seguintes critérios: náuseas/vômitos, erupções cutâneas, dores, teste do laço positivo, leucopenia sem apresentação de quaisquer sinais de alerta. Os sinais de alerta incluíram dor ou sensibilidade abdominal, vômito persistente, acúmulo clínico de líquido, sangramento da mucosa, letargia/inquietação, aumento do fígado > 2 cm e aumento do hematócrito (≥ 44%) concomitante com diminuição rápida na contagem de plaquetas (<100 × 103 por μl) . A dengue grave foi definida como: síndrome do choque da dengue (DSS), acúmulo de líquido com desconforto respiratório e/ou sangramento grave que exigiu transfusão de sangue ou envolveu um órgão [23]. A DSS foi diagnosticada pela presença de hipotensão ou pressão de pulso estreita (< 20 mmHg) [25].
Deficiência de G6PD
A classificação da OMS é baseada na atividade de G6PD expressa como uma porcentagem do valor mediano de G6PD de uma população masculina normal. As classes I-V são definidas como: classe I < 1% (associada a anemia hemolítica não esferocítica crônica), classe II 1 – < 10%, classe III 10 – <60%, classe IV 60-150% e classe V > 150 %. Neste estudo, a deficiência de G6PD foi classificada como grave, moderada ou normal se a atividade da enzima fosse < 10%, 10-60% ou > 60%, respectivamente [26]. A atividade enzimática mediana ajustada em homens foi determinada como 100% de atividade da população de estudo [22].
Análise estatística
Apenas pacientes com infecção aguda por dengue confirmada laboratorialmente foram incluídos na análise estatística. Os dados foram avaliados por meio de estatística descritiva, medianas (intervalos interquartis) para variáveis contínuas e frequências e porcentagens para variáveis categóricas. O teste qui-quadrado ou teste exato de Fisher (para variáveis categóricas) e o teste U de Mann-Whitney (para variáveis contínuas) foram usados para análises comparativas entre infecções graves e não graves por dengue e entre pacientes com ou sem deficiência de G6PD. As associações entre o estado de G6PD e a gravidade da dengue foram avaliadas usando o teste de regressão logística binária com intervalo de confiança de 95%. Os dados foram analisados usando o pacote de software gerenciador de dados estatísticos IBM SPSS (IBM, Armonk, NY, EUA).
Resultados
Recrutamento de pacientes
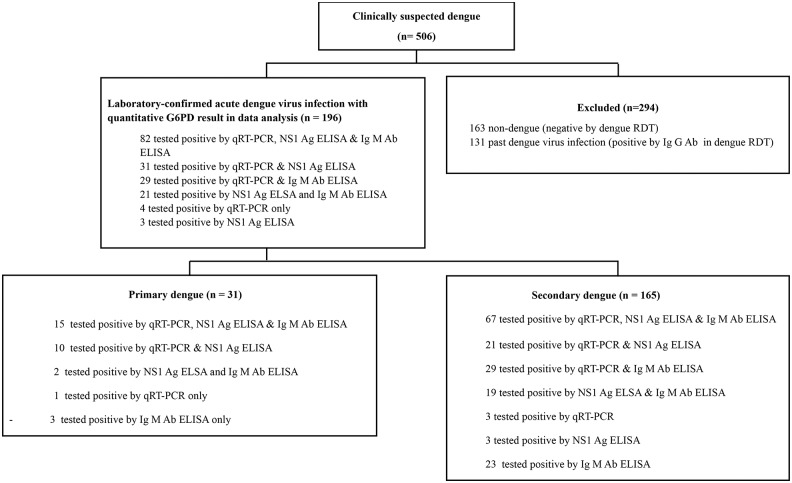
No total, 506 pacientes com suspeita clínica de infecção por dengue foram triados por RDT. Em nosso estudo, 294 (58,0%) pacientes foram excluídos (163 não-dengue e 131 com infecção anterior por dengue), e 212 pacientes foram incluídos no estudo (definido como resultado NS1 Ag e/ou IgM positivo) conforme indicado na Fig. 1 Dos 212 pacientes inscritos, 16 foram excluídos (2 não apresentavam volume sanguíneo suficiente, 11 apresentavam resultado negativo para dengue e 3 não apresentavam resultados quantitativos de G6PD). No total, 196 pacientes com infecção aguda por dengue confirmada laboratorialmente e com resultados quantitativos de G6PD foram incluídos na análise (Fig. 1).
Gravidade da dengue
Entre os 196 pacientes com infecção aguda confirmada por dengue, 51 (26,0%) foram classificados como dengue grave, enquanto 145 (74,0%) foram classificados como dengue não grave. Entre os 145 pacientes com dengue não grave, 115 (79,3%) apresentaram sinais de alerta e 30 (20,7%) não. Todos os pacientes com dengue grave apresentaram síndrome do choque da dengue (SCD). Entre esses pacientes com DSS, um paciente também apresentou sobrecarga de fluidos com desconforto respiratório e um paciente apresentou sangramento grave que necessitou de transfusão de sangue. Dez de cinquenta e uma (20,0%) das crianças com dengue grave foram internadas na UTI, e 11 necessitaram de transfusão de sangue. Os pacientes com dengue grave eram significativamente mais jovens (p = 0,001) e internados por mais tempo (p < 0,001) em comparação aos pacientes com dengue não grave. A maioria dos pacientes foi classificada como dengue secundária (84,2%, 165/196), e apenas 15,8% (31/196) foram classificados como dengue primária. Dengue grave foi significativamente maior em pacientes com dengue secundária em comparação com o grupo não grave (p = 0,007).
Náuseas e vômitos foram mais frequentes em pacientes com dengue grave (p = 0,001). No entanto, a prova do laço positiva foi menos frequente em crianças com dengue grave (p = 0,007). Outros sinais clínicos de alerta, incluindo taquicardia e hipotensão, foram significativamente detectados em pacientes com dengue grave. (p <0,001). Pacientes com dengue grave também apresentaram hematócrito significativamente mais alto, contagens de leucócitos mais altas e contagens de plaquetas mais baixas do que pacientes com dengue não grave (Tabela 1).
Status e genótipo G6PD
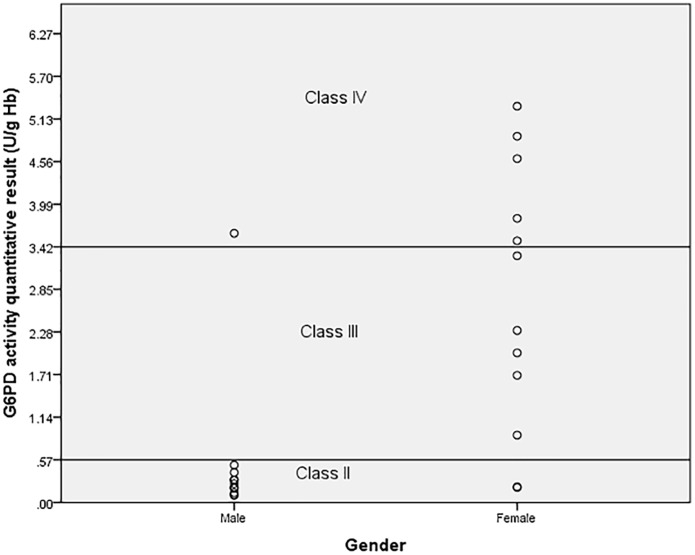
A atividade mediana de G6PD de 196 pacientes com dengue confirmada foi de 5,4 U/g Hb (0,1–11,5). O valor médio masculino ajustado da atividade de G6PD foi determinado pela exclusão de 12 amostras masculinas com ≤ 10% de atividade do valor derivado [22]. A mediana masculina ajustada foi de 5,7 U/g Hb (1,2–11,5) (Tabela 2). Com base nesse valor, a atividade de G6PD < 0,057 U/g Hb foi definida como Classe I, atividade entre 0,057–0,57 U/g Hb foi Classe II, 0,57–3,42 U/g Hb foi Classe III, 3,42–8,55 U/g Hb era Classe IV e > 8,55 U/g Hb era Classe V para essa população (Tabela 3).
A prevalência de deficiência fenotípica de G6PD, com base nesses valores de referência de corte, revelou que 14/196 (7,1%), incluindo 12 (11,7%) homens e 2 (2,2%) mulheres estavam na Classe II (deficiência grave de G6PD) e 15 /196 (7,7%), incluindo 2 (1,9%) homens e 13 (14,0%) mulheres estavam na Classe III (deficiência moderada de G6PD) (Tabela 3).
PCR em tempo real para três polimorfismos de nucleotídeo único (SNPs) conhecidos no gene G6PD em Myanmar, Mahidol, Kaiping e Mediterrâneo, foi realizado em 128 de 196 amostras confirmadas de dengue (64 homens e 64 mulheres). Entre eles, 25/128 (19,5%) tinham SNPs reconhecidos, (13/64 (20,3%) eram do sexo masculino, enquanto 12/64 (18,8%) eram do sexo feminino). Vinte e quatro pacientes apresentavam a mutação Mahidol (96%) e uma mulher (4%) apresentava a mutação Kaiping. O genótipo Mediterrâneo não foi detectado. Amostras de 28/29 (96,5%) (14/14 homens, 14/15 mulheres) pacientes com fenótipos deficientes em G6PD foram incluídas neste estudo genotípico. Entre eles, apenas 20/28 (71,4%) apresentavam mutações, enquanto 9/28 (32,1%) (2 homens e 7 mulheres) não apresentavam mutação. Entre as amostras de pacientes sem fenótipo G6PD deficiente, 6/100 (6%) amostras (1 masculino e 5 feminino) apresentaram mutações (Tabela 4).
Entre os 25 pacientes com mutação G6PD, 14/25 (56,0%) foram classificados como classe II da OMS e, dentre eles, 13/14 (92,8%) eram homens heterozigotos e um sexo feminino homozigoto. Havia um homem com a mutação Mahidol na Classe IV da OMS. Este paciente apresentou uma contagem de reticulócitos < 2% durante o teste de atividade de G6PD. As mulheres com mutações genotípicas têm graus variados do fenótipo deficiente em G6PD, sendo classificadas como classe II da OMS a classe IV da OMS (Fig. 2).
Associação de gravidade da dengue e status G6PD
A dengue grave não foi associada a um fenótipo de deficiência de G6PD nem variantes de genótipos, quer usássemos um corte de < 30% (ou seja, incluindo apenas homens hemizigotos e mulheres homozigotas) ou um corte de < 60%, correspondendo às classes I a III do Classificação da OMS (Tabela 5).
Dengue grave foi diagnosticado em 5/29 (17,2%) crianças com atividade enzimática < 60% e em 46/167 (28%) crianças com níveis de G6PD > 60% (p = 0,249). Além disso, 6/25 (24%) participantes do estudo tinham um SNP G6PD e 25/103 (24%) não tinham um SNP detectável e dengue grave (p = 0,977).
Discussão
Aqui, investigamos se existe uma associação entre dengue e deficiência de G6PD em crianças em Myanmar. A maioria das crianças neste estudo, 84,2%, teve infecção secundária por dengue, possivelmente devido aos quatro sorotipos de dengue circulando nesta área endêmica, o que leva a infecções subsequentes [19]. Um quarto das crianças do presente estudo teve dengue grave, todas com SCD. A frequência de infecção secundária por dengue foi significativamente maior no grupo de dengue grave do que no grupo de dengue não grave, o que é consistente com uma meta-análise de 40 estudos na Ásia que descreveu a associação entre DSS e infecção secundária por dengue [27].
Nenhuma associação entre a gravidade da infecção por dengue e a deficiência da enzima G6PD ou mutação G6PD foi detectada. O resultado deste estudo é consistente com dois estudos anteriores conduzidos na Tailândia [28, 29]. Tanphaichitr e colegas não demonstraram uma correlação entre a deficiência de G6PD e a gravidade da dengue em 89 pacientes pediátricos do sexo masculino (faixa etária: 1–13 anos) com idade de febre hemorrágica da dengue. Neste estudo, 17 de 72 pacientes tinham deficiência de G6PD [28]. Seridhoranakul et al. também não demonstrou uma relação significativa entre deficiência de G6PD e DHF em um estudo com 80 pacientes com DHF, em que 9 pacientes eram deficientes em G6PD, e 131 controles, nos quais 13 pacientes eram deficientes em G6PD [29]. Tanphaichitr et al. relataram uma maior prevalência de deficiência de G6PD em pacientes homens com DHF, que foi de 19,1% em comparação com 12% em Bangkok, e sugeriram que homens com deficiência de G6PD podem sofrer mais de DHF [28]. A prevalência de deficiência de G6PD em pacientes pediátricos com infecção por dengue no presente estudo foi menor do que a prevalência de deficiência de G6PD em crianças que visitaram o Departamento de Emergência do Yankin Children Hospital, com idades: 1 mês a 12 anos, que foram rastreadas para dengue via RDT (14,8% vs. 18,5%, respectivamente). Neste estudo, a deficiência de G6PD foi diagnosticada se a atividade da enzima fosse < 60% do valor mediano ajustado, que era ligeiramente inferior ao valor mediano ajustado em nosso estudo (3,24 U/g Hb vs. 3,42 U/g Hb) [30] . Ao comparar os resultados desses dois estudos, conduzidos no mesmo ambiente, crianças deficientes em G6PD podem não ser mais suscetíveis à infecção por dengue em comparação com crianças com atividade normal de G6PD.
Dois estudos in vitro demonstraram que os monócitos humanos de indivíduos com deficiência de G6PD tinham maior replicação do sorotipo 2 do vírus da dengue [5, 6], e esses estudos sugeriram que a probabilidade de dengue grave provavelmente aumentaria em indivíduos com deficiência de G6PD. Os achados de nosso estudo não apoiaram essa hipótese. No entanto, a carga viral não foi avaliada em nosso estudo, portanto, a associação da carga viral ou replicação viral a desfechos clínicos estava além do escopo deste estudo. Os diferentes sorotipos de dengue também afetam os resultados clínicos. Embora os sorotipos da dengue não tenham sido avaliados neste estudo, estudos anteriores descreveram que o sorotipo prevalente entre os pacientes com FHD em Mianmar nos últimos anos foi o sorotipo 1 da dengue [31, 32]. Além disso, todos os quatro sorotipos participaram do surto de 2015 [19]. A associação entre deficiência de G6PD, carga viral e diferentes sorotipos de dengue justifica estudos futuros.
Mais de 180 mutações diferentes no gene G6PD foram identificadas, e essas variantes têm diferentes impactos na atividade enzimática [33], o que pode resultar em diferentes manifestações clínicas. Um estudo relatou que pacientes com a mutação G6PD Mediterrâneo apresentaram um curso clínico mais grave durante a infecção bacteriana em comparação com pacientes com G6PD do tipo selvagem [34].
A maioria dos pacientes com mutação G6PD possuía a variante Mahidol, o que é consistente com estudos anteriores em Mianmar [10, 14]. A mutação genotípica não foi detectada em 2 pacientes do sexo masculino e 7 do sexo feminino com deficiência fenotípica e pode ter sido devido ao número limitado de genótipos que buscamos; pesquisas anteriores nesta região identificaram outras mutações G6PD incomuns, por exemplo G6PD Union, Coimbra e Canton [14, 35, 36]. Bancone et al relataram essa heterogeneidade molecular entre essa etnia ao longo da fronteira Tailândia-Mianmar [35]. Seis pacientes (1 homem e 5 mulheres) que tinham mutação genotípica tinham atividades normais de G6PD; todos tinham contagem de reticulócitos < 2%, excluindo um fenótipo falso negativo devido à hemólise. G6PD Mahidol é considerado uma variante moderadamente grave com atividades variadas de G6PD, o que o classifica como classe II/III da OMS; quase todos os pacientes do sexo masculino com a variante Mahidol tinham atividades enzimáticas < 10% (ou seja, eram classe II). Esta descoberta é consistente com os resultados de outro estudo da fronteira Tailândia-Mianmar [35]. Não foi encontrada associação significativa entre a mutação G6PD, predominantemente na variante Mahidol, e a infecção por dengue. Se outros genótipos G6PD além do Mahidol poderiam afetar a gravidade da dengue não pode ser excluído com base em nosso estudo atual. Assim, o efeito de outras mutações do gene G6PD na infecção por dengue é desconhecido, e estudos complementares devem ser realizados em diferentes populações.
Neste estudo, os parâmetros demográficos, clínicos e hematológicos de pacientes com dengue grave e não grave foram comparados e descobrimos que a idade jovem é um fator de risco significativamente associado à infecção por dengue grave. Dados coletados de 2011 a 2015 em Mianmar também relataram que a maior taxa de letalidade foi observada na faixa etária infantil [19].
Os parâmetros clínicos dos sinais de alerta foram mais frequentes em pacientes com dengue grave, o que está de acordo com estudos anteriores; hepatomegalia foi um fator de risco de SCD ou infecção grave por dengue [37-42], dor abdominal foi um fator prognóstico para dengue grave [43, 44] e letargia foi o melhor sinal clínico para identificar pacientes que podem evoluir para dengue grave [45 ]. Embora não houvesse pacientes com vômitos persistentes, aqueles com história de vômitos foram mais frequentes no grupo de pacientes com dengue grave. Outros estudos relataram que o vômito persistente foi um dos fatores associados à DSS ou alta mortalidade [27, 37]. Na classificação da OMS de 2009 para dengue, hematócrito alto ≥ 20% da linha de base, concomitante com uma contagem de plaquetas decrescente rápida, é listado como um sinal de alerta [23]. Neste estudo, pacientes com dengue grave apresentaram hematócrito significativamente maior e contagem de plaquetas menor do que aqueles com dengue não grave. As descobertas deste estudo também reforçaram a aplicabilidade dos sinais de alerta descritos nas diretrizes da OMS de 2009 para detectar infecção grave por dengue em crianças em Mianmar.
A força deste estudo foi seu desenho prospectivo. Todos os casos agudos de dengue foram confirmados por PCR em tempo real para o vírus e ensaios ELISA, e a deficiência de G6PD foi confirmada por um ensaio espectrofotométrico quantitativo padrão-ouro. Embora o nível de corte da atividade de G6PD não represente todas as crianças em Mianmar, ele refletiu a atividade de G6PD de crianças com infecção por dengue atendidas no Yankin Children Hospital.
Houve limitações em nosso estudo. Por exemplo, a carga viral da dengue e os sorotipos não foram analisados; portanto, não conseguimos detectar a relação entre carga viral, sorotipos, gravidade da dengue e deficiência de G6PD. Além disso, as mutações de G6PD não foram avaliadas em todos os participantes, e o impacto de variantes raras de G6PD relatadas anteriormente na população de Mianmar não pôde ser analisado, o que pode ter impactado nossa análise estatística. Os parâmetros, por exemplo, radiografias de tórax, testes de função hepática e ultrassonografias de tórax e abdome que podem afetar a classificação da gravidade da dengue em termos de envolvimento de órgãos importantes ou evidência de extravasamento de plasma não foram coletados e esses fatores podem ter afetado os resultados de nosso estudo.
Conclusão
Não encontramos associação entre a deficiência de G6PD e a gravidade da dengue. A maioria dos nossos pacientes tinha G6PD Mahidol, a variante mais comum em Mianmar. Este estudo propõe pontos de corte de atividade enzimática de acordo com a classificação da OMS, bem como a prevalência de deficiência de G6PD e a mutação genética predominante entre pacientes pediátricos. Este estudo reconfirma a utilidade da classificação de dengue de 2009 da OMS em pacientes pediátricos com dengue em Mianmar. Mais pesquisas são necessárias para explorar outros fatores relacionados à gravidade da dengue, como carga viral do vírus da dengue, sorotipos e genótipos DEN do vírus da dengue.
Leia o Artigo Original completo AQUI

