Manejo de atletas com deficiência de G6PD: perder uma enzima significa perder mais jogos?
Abstrato
Contexto:
A deficiência de glicose-6-fosfato desidrogenase (G6PD) é provavelmente a deficiência enzimática mais prevalente no planeta, com cerca de 4,9% das pessoas, ou aproximadamente 330 milhões de indivíduos, em todo o mundo afetados pela doença. Nos Estados Unidos, 4% a 7% da população provavelmente é afetada, mas a cada ano as principais ligas esportivas de nosso país se tornam mais internacionais. É importante que os profissionais médicos que tratam atletas entendam como essa condição genética pode afetar os atletas com os quais trabalhamos, principalmente porque o exercício em si resulta em estresse oxidativo.
Aquisição de Evidências:
PubMed foi pesquisado por artigos relevantes publicados de 1980 a 2018. Os termos de pesquisa G6PD, atletas, militares e esportes foram usados.
Resultados:
Embora alguns relatos de casos sugiram um impacto potencial na segurança e no desempenho do atleta, estudos controlados demonstram um impacto limitado do exercício no estresse oxidativo em indivíduos com deficiência de G6PD. O atendimento de atletas com deficiência de G6PD não difere drasticamente do atendimento de atletas sem essa condição. A maioria dos medicamentos e suplementos administrados regularmente aos atletas não deve afetar negativamente sua saúde.
Conclusão:
Embora o cuidado de atletas com deficiência de G6PD não seja diferente do cuidado de outros atletas, há certas situações (visitar áreas onde a malária é endêmica) e medicamentos para os quais é importante reconhecer como sua gestão deve mudar. A deficiência de G6PD não é rastreada regularmente, mas pode ser considerada se um atleta tiver doença falciforme conhecida ou quando viajar para áreas onde a malária é prevalente. Expandir nosso conhecimento sobre a deficiência de G6PD permitirá um melhor atendimento aos atletas.
Apresentação científica e clínica da deficiência de G6pd
Em um ser humano não afetado, a glicose-6-fosfato desidrogenase (G6PD) desempenha um papel fundamental na proteção dos glóbulos vermelhos contra lesões oxidativas, catalisando a redução de NADP+ (nicotinamida adenina dinucleotídeo fosfato) a NADPH (forma reduzida de NADP+) por meio da pentose fosfato caminho (Figura 1). Sem NADPH adequado, a glutationa oxidada não pode ser reduzida. À medida que os níveis aumentam, os glóbulos vermelhos sofrem hemólise devido ao estresse oxidativo criado pelo excesso de glutationa.20 A G6PD na via das pentoses fosfato é uma resposta fisiológica importante ao estresse oxidativo (como o exercício). Um estudo com 10 indivíduos ativos (2 horas de exercício/dia) e 10 sedentários (0 horas de exercício) mostrou que o exercício pode aumentar a atividade da G6PD 24 horas após a atividade aeróbica em indivíduos que se exercitam 2 horas por dia, mas não em participantes sedentários. 7
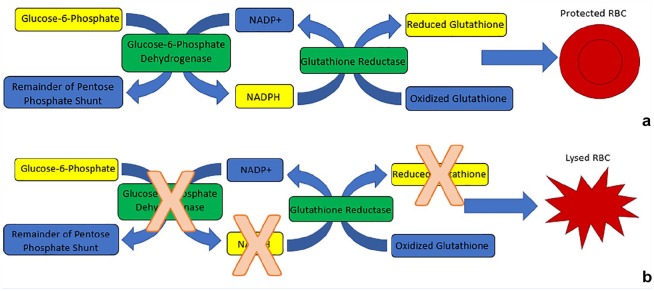
Figura 1.
vias G6PD. A porção superior (A) representa a via de reação que protege os glóbulos vermelhos (RBC) em indivíduos sem deficiência enzimática. A porção inferior (B) representa a via em indivíduos com deficiência de glicose-6-fosfato desidrogenase, resultando em aumento da lise de hemácias. Na figura, uma caixa azul indica um componente oxidado, amarelo indica um componente reduzido e verde representa uma enzima. NADP+, nicotinamida adenina dinucleotídeo fosfato; NADPH, forma reduzida de NADP+.
Existem 5 variantes diferentes da deficiência classificadas pela Organização Mundial da Saúde. As variantes são diferenciadas com base no grau de deficiência enzimática e na gravidade da resposta hemolítica ao estresse oxidativo. As classes I a III apresentam deficiências enzimáticas associadas a uma resposta hemolítica, a classe IV é considerada o “tipo selvagem” sem diferença mensurável, enquanto a classe V está associada a um aumento da atividade enzimática. Portanto, apenas as 3 primeiras classes são consideradas clinicamente relevantes.11
Pacientes com deficiência de G6PD são frequentemente assintomáticos. Certos alimentos (classicamente favas), antibióticos e infecções são gatilhos conhecidos para os afetados pela doença.3 A deficiência de G6PD se manifesta durante períodos de estresse oxidativo, que causa anemia hemolítica caracterizada por fadiga, dores musculares e nas costas, esplenomegalia e icterícia. Anormalidades laboratoriais podem incluir anemia, reticulocitose, hematúria, baixa haptoglobina, hiperbilirrubinemia não conjugada, elevação das enzimas hepáticas e elevação da lactato desidrogenase.5
Como médicos, cuidamos de indivíduos que levam seus corpos e mentes a limites extremos durante o treinamento e a competição. Existem riscos com esse tipo de esforço, mesmo em atletas sem antecedentes médicos ou fatores intrínsecos que possam predispor a lesões, doenças ou sequelas a longo prazo. Esses riscos podem ser ainda maiores quando condições médicas subjacentes estão presentes e podem ser necessárias limitações. Como cuidamos de uma população de pacientes com antecedentes ancestrais altamente diversos, podemos encontrar atletas com condições que, se não forem consideradas, podem ser prejudiciais à saúde do atleta por sua atividade ou intervenções iatrogênicas. A deficiência de G6PD é uma dessas condições. Esta revisão da literatura é projetada para expor os perigos potenciais em atletas com esta condição.
Epidemiologia
A deficiência de G6PD é a deficiência enzimática mais prevalente no planeta, com cerca de 4,9% das pessoas, ou aproximadamente 330 milhões de indivíduos, em todo o mundo afetados pela doença. As populações mais densamente afetadas são encontradas nas regiões tropicais e subtropicais da África (7,5%), Oriente Médio (6%), Ásia (4,7%) e Europa (3,8%, particularmente no Mediterrâneo). Internamente, estima-se que entre 4% e 7% da população dos EUA seja afetada, a maioria dos quais descendentes de origem africana e mediterrânea.23
Um olhar mais atento aos atletas e recrutas militares revela que uma pequena porcentagem dessas subpopulações é afetada pela doença. Na década de 1970, um estudo com 101 atletas afro-americanos mostrou que 1,9% eram deficientes em G6PD.24 Também nessa época, recrutas afro-americanos masculinos da Marinha e da Marinha foram examinados quanto à doença e 12,6% foram afetados.27 Dados mais recentes de mais de 63.000 recrutas do Exército revelaram que 2,5% dos homens e 1,6% das mulheres (4,1% das mulheres afro-americanas) foram afetados. Recrutas afro-americanos e asiáticos tiveram as taxas mais altas de deficiência de G6PD, com variantes de classe III e classe IV sendo predominantes em homens e mulheres, respectivamente.6
Além disso, as principais ligas esportivas do país estão se tornando mais internacionais. À medida que essa tendência continua, um número crescente de indivíduos das regiões mais densamente afetadas participará das ligas esportivas profissionais dos EUA. Isso é visto com mais destaque na National Basketball Association (NBA) e na Major League Soccer (MLS). As escalações da NBA para a temporada de 2017 mostraram atletas da África (3%) e da Europa (12%), com a MLS mostrando 6% da África e 11% da Europa (não incluindo a Inglaterra).1
Impacto do exercício
As implicações definitivas do exercício em indivíduos com deficiência de G6PD são desconhecidas. As complicações clínicas relacionadas ao exercício e à deficiência de G6PD dependem da percepção de um pequeno número de estudos de caso de atletas com a doença. Em uma série de casos de 4 pacientes com deficiência de G6PD, 2 pareciam ter complicações relacionadas à atividade.4,9,17 Esses casos apresentam sintomas inespecíficos que podem ser observados em pacientes saudáveis após exercícios extenuantes. Em alguns casos, a deficiência de G6PD foi diagnosticada após o desenvolvimento de uma complicação médica relacionada ao exercício, enquanto em outras situações os indivíduos sabiam que tinham deficiência de G6PD ou tinham outras condições concomitantes que os colocavam em risco aumentado.
Em contraste, estudos controlados mostraram um impacto limitado do exercício no estresse oxidativo em indivíduos com deficiência de G6PD, sugerindo que exercícios extenuantes independentes da deficiência de G6PD podem ter desencadeado sintomatologia.14 O exercício pode induzir estresse oxidativo e atletas condicionados podem desenvolver tolerância ao estresse oxidativo.10 No entanto, não há diferença mensurável no grau de estresse oxidativo entre controles normais e deficientes em G6PD. Dois estudos usando biomarcadores de estresse oxidativo como um indicador de lesão celular não mostraram diferenças em atletas com e sem deficiência de G6PD durante exercícios aeróbicos intensos.14,21 Da mesma forma, exercícios excêntricos parecem ser bem tolerados na deficiência de G6PD. Um estudo de 9 indivíduos masculinos deficientes em G6PD com 9 controles masculinos mostrou que um protocolo de exercício excêntrico que causava dano muscular causava dano muscular (aumento da creatina quinase sérica), hemólise (aumento da bilirrubina) e estresse oxidativo com efeitos máximos observados 2 a 3 dias após exercício, mas não houve diferença entre os grupos.26
Medicamentos e Suplementos
Drogas anti-inflamatórias não esteróides e antimicrobianos são prescritos para atletas com mais frequência do que controles da mesma idade. Além disso, doses inadequadamente altas, bem como a prescrição de diferentes medicamentos da mesma classe, podem ocorrer em atletas.28 Alguns medicamentos podem causar hemólise em indivíduos com deficiência de G6PD e, portanto, devem ser considerados ao prescrever a essa população.3,12
A lista de medicamentos provavelmente inseguros na deficiência de G6PD é bastante curta e não inclui nenhum medicamento frequentemente prescrito para atletas (Tabela 1, adaptada de Luzzatto e Seneca19 e Youngster et al28). Também reconhecemos que alguns medicamentos, como acetaminofeno, ibuprofeno e trimetoprima-sulfametoxazol, já foram considerados inseguros.3,28 Com base em nossa revisão da literatura, acreditamos que os medicamentos não listados na Tabela 1 e mesmo aqueles considerados “inseguros ” deve ser considerado seguro ao prescrever a pacientes com deficiência de G6PD e administrado em doses terapêuticas usuais. Alternativamente, muitos fornecedores de medicamentos geralmente prescrevem não causam hemólise na deficiência de G6PD, como esteróides, relaxantes musculares, medicamentos para alívio do resfriado e medicamentos antialérgicos. Existem circunstâncias únicas nas quais um medicamento da Tabela 1 pode ser prescrito se o risco for adequadamente avaliado. Por exemplo, um atleta com deficiência de G6PD viajando para áreas onde a malária é prevalente usaria mefloquina ou atovaquona-proguanil como profilaxia, mas se a resistência exigir primaquina, então deve ser considerada. Além disso, pacientes com deficiência de G6PD em risco de síndrome de lise tumoral recebem alopurinol para controlar a hiperuricemia, mas no cenário de insuficiência renal ou cardíaca, a rasburicase é preferida.15,19
Atletas são uma população única de pacientes, pois muitas vezes buscam obter qualquer tipo de vantagem competitiva, especialmente em relação à dieta e suplementos.2 Existe uma associação entre hemólise e leguminosas, especialmente favas, falafel (feito de grão-de-bico moído, favas , ou ambos), grão-de-bico, ervilha verde e chá verde e seus extratos.18 A associação entre suplementos fitoterápicos e dietéticos e hemólise é menos clara do que drogas e dieta. Há evidências ligando hena (tópica) à hemólise.18 Hemólise foi observada com vitamina C em doses muito altas.18 Vitamina E, vitamina K, gingko e ácido α-lipóico são considerados seguros na deficiência de G6PD.18 Houve pequenos estudos e relatos de casos mostrando evidências conflitantes de hemólise com Acalypha indica (uma erva daninha em várias partes da Ásia usada por seus alegados efeitos anti-inflamatórios, antimicrobianos e antitussígenos) e Coptis chinesis (erva comumente usada na China para várias doenças, incluindo doenças febris ).18 Curiosamente, alguns suplementos podem ser benéficos na deficiência de G6PD. A vitamina E, um antioxidante natural, pode ser protetora, e o ácido α-lipóico é um potente antioxidante para restaurar a glutationa intracelular e, portanto, pode beneficiar indivíduos com deficiência de G6PD18 (Tabela 2). Além disso, um estudo com 10 atletas descobriu que a suplementação de l-cys pode proteger a atividade de G6PD da redução, aumentando a capacidade antioxidante total e a produção de glutationa.25
Triagem para Deficiência de G6PD
As triagens de pré-participação para doenças hematológicas atualmente se concentram no estado das células falciformes; não há nenhuma pergunta de triagem específica para a deficiência de G6PD em qualquer nível do esporte. Da mesma forma, a triagem neonatal para deficiência de G6PD não é realizada rotineiramente nos Estados Unidos. A Academia Americana de Pediatria recomenda o teste para G6PD em recém-nascidos ictéricos recebendo fototerapia cuja história familiar, etnia ou origem geográfica sugerem a possibilidade da condição ou para bebês cuja resposta à fototerapia é ruim.13 Uma vez que um paciente tenha testado positivo por meio de um ensaio enzimático para redução de NADP (adquirido por meio de coleta de sangue), muitas vezes é desnecessário determinar a variante específica porque apenas as classes I a III são clinicamente significativas, e a maioria dos casos é de classe II ou III, que têm o mesmo manejo.11,22 No entanto, a variabilidade da gravidade da hemólise na população chinesa pode justificar a determinação variante (classe I vs II) se houver complicações contínuas apesar do tratamento conservador.16
Quando e quem testar?
A deficiência de G6PD deve ser considerada como uma etiologia de rabdomiólise inexplicável e anemia hemolítica, especialmente em pacientes do sexo masculino de ascendência africana, afro-americana, asiática ou mediterrânea. No entanto, dada a atual escassez de evidências sobre o risco de exercício com deficiência de G6PD, não existem recomendações atuais para triagem em indivíduos assintomáticos. Portanto, a triagem específica para ele durante o exame pré-participação, seja com um questionário ou com testes laboratoriais, não se justifica. Naqueles com deficiência conhecida de G6PD, a prática médica usual de aconselhamento deve ocorrer em relação a medicamentos e alimentos a serem evitados. A deficiência de G6PD e o traço/doença falciforme têm distribuições geográficas semelhantes e podem ocorrer juntas em até 5% dos homens afrodescendentes,8 portanto, é razoável considerar o teste de atletas com anemia falciforme para deficiência de G6PD se apresentarem rabdomiólise inexplicada ou para aqueles que podem estar expostos a medicamentos ofensivos, como medicamentos para baixar o ácido úrico ou agentes quimioterápicos. A triagem também pode ser considerada se um atleta viajar para áreas onde a malária é prevalente. Antes de prescrever qualquer um dos medicamentos que provavelmente são inseguros na deficiência de G6PD moderada a grave (classes I-III, Tabela 1), o médico deve considerar o teste para deficiência de G6PD, especialmente em populações para as quais a deficiência de G6PD é comum, como afro-americanos, Oriente Médio e Mediterrâneo.3,19
Conclusão
Embora os pacientes com deficiência de G6PD fossem pouco encontrados no passado, a globalização dos esportes exige que uma nova perspectiva seja considerada. Com base nesses dados, atletas com deficiência de G6PD não parecem ser fisicamente limitados. Em vez disso, os médicos devem estar cientes dos problemas potenciais, especialmente com medicamentos.
Leia o Artigo original completo AQUI

