Prevalência de deficiência de G6PD em municípios altamente endêmicos de malária na Amazônia brasileira: um estudo de triagem em toda a região.
Fundo
Dificuldades associadas à avaliação da deficiência de glicose-6-fosfato desidrogenase (G6PDd), particularmente em áreas remotas, dificultam o uso seguro de 8-aminoquinolinas como primaquina (PQ) e tafenoquina contra malária por Plasmodium vivax devido ao risco de hemólise.
Métodos
Este estudo transversal foi realizado em 41 municípios endêmicos de malária de seis estados da Amazônia brasileira, entre 2014 e 2018. Indivíduos do sexo masculino foram rastreados para G6PDd usando o teste qualitativo de manchas fluorescentes usando amostras de sangue total coletadas por punção digital. Estimativas de ponto e intervalo da prevalência de G6PDd foram calculadas para cada estado. Amostras deficientes foram genotipadas para as variantes mais prevalentes na Amazônia. As frequências de recorrências de malária por P. vivax foram estimadas para pacientes G6PDd e não-G6PDd.
Interpretação
Este é um dos maiores levantamentos já realizados na América Latina, abrangendo toda a área endêmica de malária na Amazônia brasileira. Esses resultados indicam que uma proporção importante da população está em risco de hemólise se exposta a PQ e sua droga congênere tafenoquina. A adoção de protocolos de triagem de G6PDd é essencial para garantir a segurança dos indivíduos tratados com essas drogas e também deve ser considerada na implementação de estratégias de eliminação da malária.
Descobertas
Foram incluídos 14.847 indivíduos, dos quais 5,6% apresentavam G6PDd. O estado do Acre teve a maior prevalência de G6PDd (8,3%), seguido por Amapá (5,8%), Pará (5,7%), Rondônia (5,4%), Roraima (4,2%) e Amazonas (4,0%). De 828 amostras genotipadas, foram encontradas variantes africanas A+ (6,2%), africanas A− (39,3%) e selvagens (não africanas não mediterrâneas; 54,2%). Uma proporção maior de recorrências de malária foi encontrada entre indivíduos com deficiência de G6PD [16,7% vs 4,1%, razão de risco 3,52 (2,16–5,74) p < 0,01].
Financiamento
Ministério da Saúde do Brasil; Fundação de Amparo à Pesquisa do Estado do Amazonas (FAPEAM).
Pesquisa em contexto
Evidências antes do estudo
Pesquisamos no PubMed os seguintes termos: ‘Deficiência de G6PD’ AND ‘Amazon’. A pesquisa rendeu alguns resultados, principalmente focados no impacto clínico da deficiência de G6PD. Estudos de prevalência descreveram variantes locais dos estados do Acre e Amazonas em pequenos inquéritos transversais. Uma revisão sistemática de 2014 descreveu a africana como a variante mais prevalente na América Latina, em que a deficiência varia entre 4 e 10% na Amazônia.
Valor agregado do estudo
Até onde sabemos, este é o maior levantamento de prevalência já realizado na América Latina, abrangendo toda a área endêmica de malária no Brasil. Nossos resultados revelaram uma prevalência de 5,6% de G6PDd na região e indivíduos com G6PDd tiveram maiores chances de recorrência, que é um novo episódio de malária mesmo sem uma nova picada de mosquito.
Implicações de todas as evidências disponíveis
Em áreas endêmicas de malária no Brasil, a triagem de G6PDd deve ser associada ao teste de malária, para minimizar o risco de PQ ou hemólise induzida por tafenoquina naquele momento e também para mitigar recorrências, fornecendo alternativas de cura radical mais seguras, como regime semanal de PQ.
Introdução
Primaquina (PQ) e tafenoquina (TQ), os únicos medicamentos disponíveis para a cura radical da malária por Plasmodium vivax, são potencialmente prejudiciais se administrados a indivíduos com deficiência de glicose-6-fosfato desidrogenase (G6PDd).1 Mutações no gene G6PD podem desestabilizar o enzima deixando as células propensas a danos causados por gatilhos exógenos que levam à anemia hemolítica aguda (AHA).2 Os sintomas clínicos variam de leves a fatais, dependendo em grande parte das variantes de G6PD envolvidas e da dosagem da droga.3,4
No Brasil, os pacientes com malária por P. vivax recebem cloroquina mais um tratamento de curta duração com PQ (0,5 mg/kg/dia, 7 dias).5 Em caso de novo episódio no dia 60, são prescritos com 0,5 mg/kg /dia por 14 dias. Atualmente, não existem medidas para garantir a administração segura de PQ neste contexto, como a triagem de G6PD e o uso do regime de PQ semanal mais seguro,6 representando um desafio para as estratégias atuais de controle e eliminação da malária.7,8 Como resultado de uso indiscriminado de PQ, anemia com risco de vida, insuficiência renal aguda, gerenciamento de terapia intensiva e morte foram relatados,4,9,10 e os custos associados a eventos adversos graves entre portadores de G6PDd foram estimados em US$ 5 milhões no Brasil Amazônia, demonstrando o significativo impacto econômico e social da ausência de diagnóstico oportuno de G6PDd.11
Apesar da importância clínica e epidemiológica da interação entre G6PDd e malária, a extensão de sua ocorrência e as consequências para os pacientes têm sido pouco exploradas em populações que vivem na Amazônia brasileira.12, 13, 14, 15 Melhor compreensão da frequência relativa de variantes do gene G6PD daria suporte a avaliações para estratégias de administração segura e cura radical.16,17 Portanto, este trabalho visa fornecer um mapeamento preciso e abrangente da deficiência de G6PD em áreas endêmicas de malária na Amazônia brasileira.
Métodos
Projeto de estudo e locais
Este estudo de prevalência foi realizado em 41 municípios em 6 estados brasileiros: Acre, Amazonas, Amapá, Pará, Roraima e Rondônia de 2014 a 2018. De todos os casos de malária no Brasil, mais de 99% ocorrem na região amazônica, dos quais cerca de 89% são atribuíveis a infecções por P. vivax.18 A maioria desses casos (80%) concentra-se em municípios dos estados estudados. Os municípios foram selecionados por apresentarem maior Índice Parasitário Anual19 e/ou por sua participação no número de casos de malária em cada estado (Tabela Complementar 1). As estimativas de prevalência de G6PDd foram calculadas para cada um dos estados. Este estudo foi relatado de acordo com a Declaração de Fortalecimento do Relatório de Estudos Observacionais em Epidemiologia (STROBE) (Lista de Verificação Suplementar do STROBE).
Cálculo do tamanho da amostra
O tamanho da amostra foi calculado para estimar a prevalência de G6PDd considerando os seguintes parâmetros: (i) população de cada estado; (ii) estimativa pontual da deficiência de G6PD obtida em estudos preliminares no estado do Amazonas equivalente a 4,5% no sexo masculino13; precisão de ±1,0% para cada estado; e um nível de confiança de 95%. De forma conservadora, optou-se por aumentar o tamanho da amostra, usando um efeito de desenho de 1,5 para mitigar a heterogeneidade entre os estados. Assim, estimou-se uma amostra de 2.473 participantes do sexo masculino por estado, levando a uma amostra total estimada de 14.838 participantes.
Critério de inclusão
Os participantes do sexo masculino foram incluídos independentemente da idade em municípios com alto número de casos de malária, que seriam os mais beneficiados, assumindo que os efeitos deletérios da hemólise associada à 8-aminoquinolina causariam o maior impacto em termos de morbidade e mortalidade.3,4 Pacientes com sinais de malária (por exemplo, febre e/ou calafrios) no momento da triagem foram excluídos. Testes qualitativos laboratoriais e de triagem de G6PD no local de atendimento detectam hemizigotos e homozigotos com alta sensibilidade e especificidade,20 no entanto, mulheres heterozigotas podem expressar fenótipos de atividade de G6PD que variam de totalmente deficientes a completamente normais como consequência do mosaicismo de suas populações de glóbulos vermelhos. 21 Esse problema impõe incerteza em relação a uma leitura diagnóstica de ‘normal’ (e elegibilidade para terapia com primaquina) por esses testes entre as mulheres. Portanto, para este estudo inicial, optamos por não incluir participantes do sexo feminino, para certificar um cálculo de prevalência preciso com o teste de triagem selecionado.
Coleta de amostras e caracterização do fenótipo G6PDd
A Organização Mundial da Saúde (OMS) recomenda o teste de mancha fluorescente para triagem populacional.2,16,22,23 Trabalhadores de campo foram treinados para coleta de amostras em uma instituição de referência em Manaus, Brasil. As amostras foram coletadas por meio de visitas domiciliares (apenas um indivíduo por domicílio, o mais velho se mais de um presente) e em locais de grande circulação na periferia urbana dos municípios. Inicialmente, o sangue venoso foi coletado por punção digital e armazenado em tubos de microcentrífuga de 1 mL com EDTA e transportado em recipientes refrigerados para realização do teste de ponto fluorescente (FST) (R&D Diagnostic, Grécia) no laboratório associado mais próximo, até três horas após a coleta . Concomitantemente, foram coletados dados socioepidemiológicos e histórico da doença por meio de questionário padronizado.
Resumidamente, o spot test foi realizado usando cinco microlitros de sangue que foram misturados com 100 μL de reagentes, incubados por 10 min em temperatura ambiente, manchados em papel de filtro e secos ao ar. Os testes pontuais foram então visualizados sob luz ultravioleta por um técnico de laboratório treinado. Manchas sem fluorescência ou fluorescência leve foram classificadas como deficientes em G6PD e fluorescência forte como normais.24 Cada resultado foi lido por dois membros treinados e depois fotografado para ser lido por um terceiro revisor independente em Manaus. Os leitores do FST ficaram cegos em relação a outros resultados.
Aproximadamente 500 µL de sangue total foram armazenados a -20 °C e a genotipagem de amostras deficientes de G6PDd foi realizada na Fundação de Medicina Tropical Dr. Heitor Vieira Dourado, Manaus, Brasil.
Extração de DNA e genotipagem da variante G6PD
Aproximadamente 200 µL de sangue total de pacientes previamente identificados como G6PDd tiveram seu DNA extraído. A extração do DNA do sangue total foi realizada pelo método de extração em placa (Biopur Mini Cent). A genotipagem foi realizada por meio de ensaios de discriminação alélica, por meio do sistema Taqman para Single Nucleotide Polymorphisms – SNPs Genotyping.25 As variantes africana (A+ e A−) e mediterrânea (B) da G6PDd, as mais prevalentes no Brasil,14 foram identificadas por meio do detecção dos polimorfismos G202A, A376G e C563T. As análises foram feitas no software 7500 Fast Real-time PCR (Reação em Cadeia da Polimerase) v2.3 (Applied Biosystems) de acordo com as recomendações do fabricante. Para o ensaio QMAL, amostras deficientes foram pareadas com amostras normais (proporção 3:1) usando idade, sexo e município.
Recorrências (infecções novas ou recorrentes)
Os episódios e recorrências do índice de malária por P. vivax (infecções novas ou reincidentes não puderam ser realmente diferenciadas aqui) registrados no Sistema Nacional de Informações de Vigilância Epidemiológica da Malária (SIVEP Malária) entre janeiro de 2011 e dezembro de 2020, foram analisados neste estudo. Participantes com esfregaço de sangue espesso (TBS) positivo para Plasmodium spp. foram tratados de acordo com as Diretrizes Brasileiras de Tratamento Antimalárico.5 O nome do paciente, a data de nascimento e o nome da mãe foram usados para ligação probabilística entre a pesquisa G6PDd e os bancos de dados SIVEP Malária. Todas as correspondências foram verificadas duas vezes e as correspondências falsas foram excluídas. Essa inspeção incluiu a confirmação visual de homônimos, possíveis irmãos (gêmeos) e duplicidade.26 Obtivemos uma seleção final de pares identificados como provavelmente dos mesmos pacientes por verificação automática, aplicando um limite de probabilidade (probabilidade > 0,7) para todas as ligações . Uma identificação final (ID) foi criada para todos os participantes incluídos.
Análise estatística
A prevalência de deficiência de G6PD e suas variantes foram calculadas em proporções, com intervalo de confiança de 95%. Os dados do SIVEP-malária foram importados, curados e vinculados pelo software fastLink 0.6.0 R. Estatísticas descritivas foram usadas para variáveis demográficas. O teste exato de Fisher ou qui-quadrado (X2) foi usado para comparar as proporções de recorrências de P. vivax em grupos normais e deficientes de G6PD. O Risco Relativo Bruto (RR) com seu respectivo Intervalo de Confiança de 95% (IC 95%) foi determinado em uma análise univariada. A regressão logística foi utilizada para as análises multivariadas e os RR ajustados (ARR) com IC 95% também foram estimados. Uma regressão linear generalizada binomial multivariada logarítmica foi realizada usando uma estimativa automática para trás e para frente passo a passo. Todas as variáveis com associação em nível de significância de P < 0,20 na análise univariada foram incluídas na análise multivariada. A significância estatística foi considerada se P < 0,05 no teste de ajuste de Hosmer-Lemeshow. Um P bicaudal < 0,05 foi considerado significativo. As análises estatísticas foram realizadas usando o software R (versão 4.1.0), RStudio (versão 1.4.17) e Stata v.13.0 (Stata Corp LP, College Station, TX).
Autorização ética
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Fundação de Medicina Tropical Dr. Heitor Vieira Dourado (FMT-HVD) (CAEE: 8307814.7.0000.0005). Todos os participantes do estudo (e seus representantes legais, se aplicável) forneceram consentimento informado por escrito para participar.
Papel da fonte de financiamento
Os financiadores não tiveram nenhum papel no desenho do estudo, coleta e análise de dados, decisão de publicar ou preparação do manuscrito.
Resultados
Participantes e status G6PD
Um total de 14.847 amostras foi coletado proporcionalmente entre os seis estados estudados. Desses, 828 (5,6%) tiveram resultado deficiente em G6PD. O estado do Acre apresentou a maior prevalência de G6PDd (8,3%), seguido por Amapá (5,8%), Pará (5,7%), Rondônia (5,4%), Roraima (4,2%) e Amazonas (4,0%) (Figura 1). A prevalência de G6PDd para cada município é detalhada na Tabela Complementar 2 e na Figura 1.
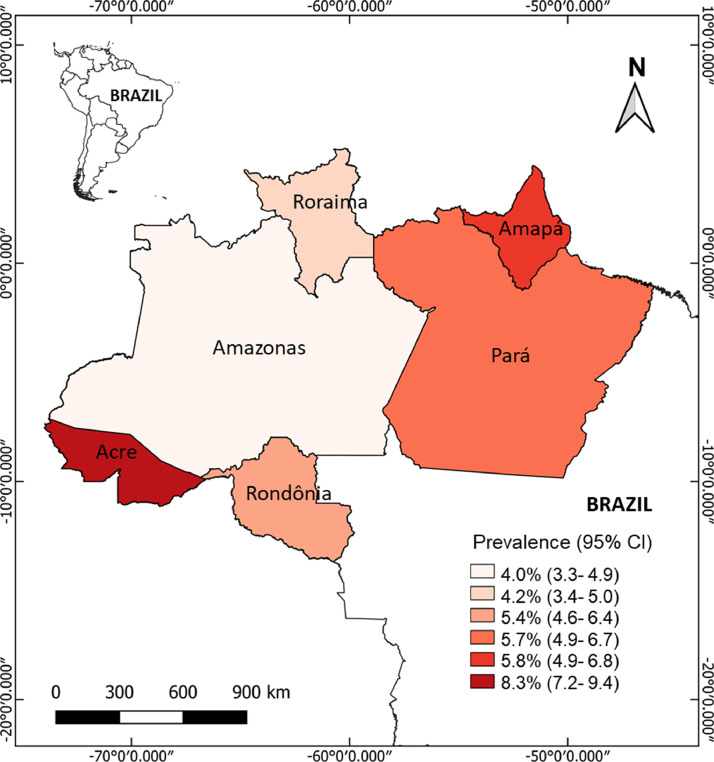
figura 1
Prevalência de deficiência de G6PD em seis estados da Amazônia brasileira.
A maioria dos participantes tinha idade entre 20 e 40 anos (46,5%), residia em áreas urbanas (94,5%), era parda (73,6%) e tinha infecção prévia por malária (45,6%). Todos os dados dos participantes estão resumidos na Tabela 1.
Entre as amostras deficientes genotipadas, foram detectadas as variantes africanas A− (n = 325; 39,3%) e A+ (n = 51; 6,2%). A maioria das amostras (449; 54,4%) foi classificada como tipo selvagem (não africana não mediterrânea). Nenhuma variante mediterrânea foi detectada.
Estado G6PD e recorrências de malária
Os participantes do G6PDd tiveram mais recorrências em comparação com os indivíduos do G6PDn (14/828, 1,7% vs 31/14.019, 0,2%, respectivamente) em 180 dias após o último episódio de malária. A Tabela 2 resume os dados moleculares sobre a infecção por malária entre os grupos no momento do teste de G6PD.
A deficiência de G6PD foi associada a um maior risco de recorrência [taxa de risco 3,52 (2,16–5,74) p < 0,01), com uma proporção maior de uma ou mais recorrências em comparação com participantes normais de G6PD ao usar dados oficialmente relatados sobre SIVEP-Malária (Tabela 3 ).
Discussão
O estudo foi desenhado para confirmar que os municípios altamente endêmicos também abrigam uma grande incidência de indivíduos deficientes em G6PD e, portanto, apoiará as decisões políticas para enquadrar programas de controle e rotina de diagnóstico nessa população específica. Aqui, os resultados de 14.847 amostras coletadas em 41 municípios endêmicos de malária na região amazônica brasileira mostram uma prevalência geral de G6PDd de 5,6%, destacando a extensão da deficiência entre diferentes locais altamente endêmicos para malária na Amazônia. Além disso, os participantes G6PDd tiveram maior risco de recorrência em comparação com os participantes G6PDn. Ao explorar a distribuição global e o mapeamento de G6PDd, a região amazônica brasileira se destaca como uma das áreas endêmicas de malária, fornecendo menos dados de qualidade, principalmente derivados de pequenos estudos. Nesta área, estimativas baseadas em modelos apontam para uma frequência alélica de 3 a 7% G6PDd.27 Em outros países endêmicos de malária da América do Sul, a distribuição e prevalência da variante G6PD são heterogêneas, atingindo mais de 10% em algumas áreas.14 Ainda , a maioria dos países ainda não tem requisitos de política para triagem de deficiência de G6PD antes da administração de medicamentos para cura radical.8 Apenas um indivíduo indígena (autorrelatado) apresentou deficiência de G6PD, corroborando relatórios anteriores sobre prevalência muito baixa nessa população.14
Curiosamente, mais da metade das amostras deficientes (54,9%) não tiveram confirmação de genotipagem de sua variante para nenhuma das três variantes mais comuns rastreadas. Embora possíveis limitações do teste FST e erros operacionais não possam ser excluídos,23,24 a possibilidade de novas variantes circulantes não deve ser descartada. Considerando o conhecimento limitado da diversidade de variantes de G6PDd na região amazônica brasileira e a representatividade da amostra deste estudo, seria oportuno e relevante realizar o sequenciamento do genoma completo dessas amostras (aqui definidas como “selvagens”) para identificar com precisão as variantes G6PDd presentes nesta amostra populacional da região amazônica brasileira.
A triagem de G6PD não é realizada rotineiramente no Brasil e o PQ é sistematicamente prescrito para todos os pacientes diagnosticados com malária por P. vivax, exceto mulheres grávidas e crianças menores de 6 meses.5,8 Até recentemente, as diretrizes nacionais para o tratamento da malária não tinham tratamento para pacientes G6PDd antes de ser atualizado em 2020, quando o tratamento PQ semanal foi incluído.5 O regime PQ semanal (0,75 mg/kg/semana por 8 semanas) é mais seguro nessa população, permitindo a recuperação da hemoglobina após as primeiras doses.28A alta taxa de recorrência no grupo G6PDd pode ser verificada devido à interrupção do tratamento devido ao medo de hemólise de episódios anteriores de malária e falta de tratamento adequado. Crenças culturais e medicina tradicional também desempenham um papel importante na adesão ao tratamento em áreas endêmicas de malária.29,30 Evidências emergentes mostram que pacientes com malária aguda podem ter atividade de G6PD significativamente maior do que indivíduos sem malária.31 Portanto, as estimativas de risco são possivelmente menores na malária pacientes. Além disso, os polimorfismos do citocromo P450 (CYP) podem influenciar indiretamente a recorrência da malária na Amazônia, alterando a taxa na qual o hospedeiro metaboliza a droga.32
A tafenoquina, um congênere do PQ em dose única com meia-vida mais longa,33 foi recentemente aprovado pelas agências reguladoras brasileiras. Seu uso em condições de vida real requer triagem quantitativa de G6PD porque apenas indivíduos com atividade enzimática superior a 70% podem receber a droga com segurança, enquanto testes qualitativos não diferenciam de forma confiável indivíduos com atividade intermediária (30 a 70%). Assim, os desafios operacionais para sua implementação precisam ser mitigados, uma vez que, uma vez administrado, seus potenciais efeitos deletérios podem não ser revertidos.34 O estudo Safeprim no Brasil mostrou que profissionais de saúde sem experiência prévia em G6PDd foram capazes de realizar corretamente um teste qualitativo (CareStartTM) e fornecer tratamento adequado no campo após uma única sessão de treinamento de 4 h.12 No entanto, tais plataformas de teste qualitativo, incluindo o FST, não podem ser usadas para promover o uso seguro de TQ devido ao nível limite de deficiência enzimática detectado (<30% de atividade). A recente disponibilidade de testes de triagem quantitativos confiáveis no local de atendimento em 30 e 70%, como o padrão G6PD,35,36 pode superar as limitações das plataformas de teste qualitativo e mudou para estudos operacionais no Brasil.37 Dessa forma, os indivíduos com atividade acima de 70% pode receber com segurança TQ.33
Este estudo teve limitações. O FST é um teste mais complexo em comparação com outras plataformas de diagnóstico rápido, exigindo equipamentos especializados e evitando testes de campo, exigindo assim que as amostras sejam enviadas de volta aos laboratórios locais para teste. A subjetividade para a interpretação do teste também pode ter desempenhado um papel, no entanto, usamos uma abordagem cuidadosa com dois técnicos cegos e uma opinião confirmatória externa para mitigar qualquer viés de interpretação. Devido às limitações dos testes qualitativos, apenas homens foram incluídos e, portanto, a ausência de dados de mulheres pode influenciar as estimativas de prevalência. O mosaicismo na população feminina torna o diagnóstico de deficiência de G6PD desafiador em comparação com os homens, deixando-os em risco de hemólise clinicamente relevante se diagnosticado incorretamente.38 A triagem quantitativa é recomendada para estudos de prevalência envolvendo mulheres para melhor discriminação. A genotipagem compreendeu apenas as variantes mais comuns relatadas anteriormente na Amazônia, mas a presença de novas variantes justifica uma investigação mais aprofundada. É possível que tenha havido uma distorção na prevalência obtida devido ao agrupamento geográfico, pois os municípios com maior incidência de malária foram selecionados propositadamente para o inquérito. No entanto, esse processo de amostragem foi escolhido para garantir que a prevalência de G6PDd obtida possa ser usada estrategicamente para moldar programas de controle em áreas prioritárias. Nenhuma medida de hemoglobina foi realizada para ajudar a extrapolar resultados espúrios de FST. Deve-se tomar cuidado ao interpretar a análise de dados secundários.
Em conclusão, esses resultados indicam que uma proporção importante da população da Amazônia brasileira está em risco de hemólise devido ao uso indiscriminado de PQ. A adoção de uma triagem rotineira de G6PDd é essencial para garantir a segurança dos indivíduos que tomam PQ e deve ser considerada ao implementar estratégias de eliminação da malária. Maior cautela se aplica a mulheres heterozigotas, especialmente em estudos de lançamento de tafenoquina.
Leia o Artigo original completo AQUI

